离子通道是细胞膜上一类含有亲水性孔道的重要膜蛋白,它们通过离子跨膜转运调控膜电位,是细胞电信号产生和传导的基础。离子通道因感受细胞内外特异的化学或物理信号刺激,如温度、酸碱度、脂质微环境、机械力、渗透压等,而开放或关闭其“闸门 (gate) ”的过程被称为通道的“门控 (gating) ”。离子通道的门控调节对细胞信号转导、细胞体积维持及细胞离子稳态调控起着关键作用。值得一提的是,今年诺贝尔生理学或医学奖颁给了两位从事离子通道科学家,表彰其发现温度觉 (TRP channel) 和触觉(Piezo channel) 感知的关键离子通道。
TRPM2通道隶属于TRP超家族M亚家族,作为一种重要的体内氧化应激感受器,近年来研究表明其激活门控受到ADPR和Ca2+严格调控,并发现其介导了包括脑卒中,糖尿病,神经退行疾病和炎症反应等氧化应激相关疾病,被认为是上述疾病的潜在治疗靶标。然而,近年来关于TRPM2通道门控机制研究虽有了一定进展 (Wang et al., Science, 2018; Huang et al., eLife, 2019) ,但人源TRPM2通道 (hsTRPM2) 孔区结构和门控调节机制仍不清楚。
2021年11月,浙江大学基础医学院杨巍、郭江涛和杨帆团队在Cell Reports杂志在线发表了研究论文"Structural and Functional Basis of the Selectivity Filter as a Gate in Human TRPM2 Channel"。文章鉴定了人源TRPM2通道离子选择性滤器分子结构,并发现其为通道离子通透的上端闸门 (gate),该研究为阐明TRPM2通道的门控机制以及以TRPM2通道为靶标的药物研发提供了新的分子基础。
该团队研究人员首先借助冷冻电镜解析首个nanodisc组装下的近原子分辨率结构 (3.76Å) ,并解析了较为完整的孔区构象 (3.68Å) 。与已解析的hsTRPM2在去垢剂(detergent)结构相比,hsTRPM2通道nanodisc结构其胞内区没有明显差别,但跨膜区电压敏感样结构域(Voltage sensoring-like domain, VSLD )和孔区结构域(pore region)则更加靠近通道孔区中心,各亚基之间距离更加紧密。
团队研究人员进一步结合计算生物学发现其孔区选择性滤器组成为“FGQI”基序,其最窄区域直径小于1Å(Toth et al., PNAS, 2012),提示可能充当通道的上端闸门(upper gate)。相反,斑马鱼(Danio rerio)和海葵(Nematostella vectensis)两个物种的TRPM2通道结构显示其选择性滤器并非为闸门,提示TRPM2通道选择性滤器的闸门机制可能存在物种差异。
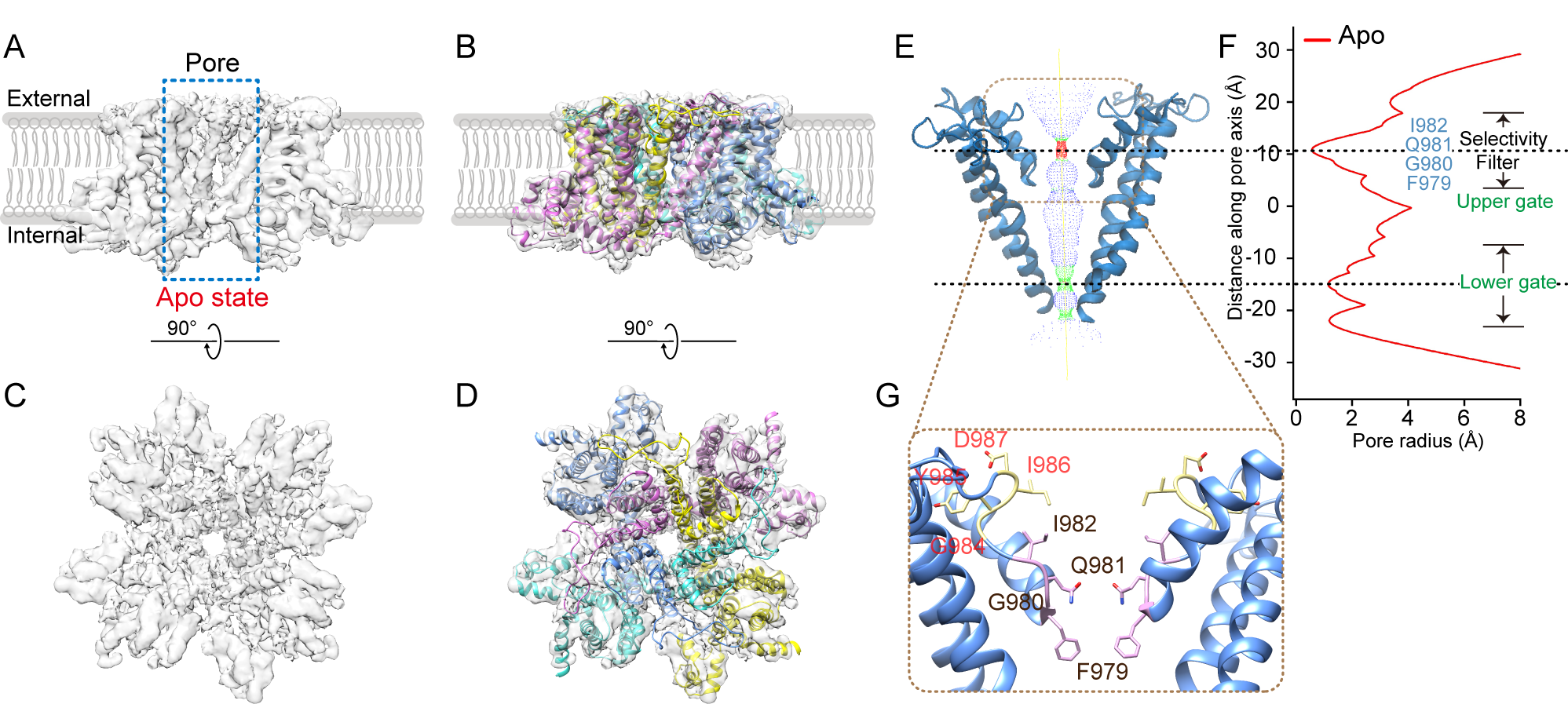
图1. 人源TRPM2孔区在nanodisc的电镜结构
为了进一步验证结构和计算预测,研究人员综合利用点突变、膜片钳电生理功能研究、基于银离子修饰的半胱氨酸可及性分析(Substituted Cysteine Accessibility Method,SCAM)等多种研究手段,发现“FGQI”基序的突变会引起全细胞TRPM2通道电流明显减弱。单通道记录结果表明“FGQI”基序的突变会引起Ca2+外液下翻转电位改变,对Ca2+与Na+通透率和单通道电导(Single channel conductance)也发生了改变。证明“FGQI”基序确实是TRPM2通道选择性滤器。
为了进一步探究选择性滤器是否形成闸门,研究人员引入SCAM,其原理是基于银离子(Ag+)与半胱氨酸残基(Cysteine)接触会形成共价结合,进而观察是否影响通道电流特征来判定。
有趣的是,hsTRPM2通道在关闭状态下给予银离子孵育并不影响其通道功能,而在hsTRPM2通道孔区引入半胱氨酸突变后,仅在通道开放时才会有Ag+通过,进而导致通道失活,证明该选择性滤器确实作为通道闸门。而在低等动物海葵TRPM2 (nvTRPM2) 通道中,则发现其关闭态下即可允许Ag+通过,进而修饰引入的半胱氨酸,并导致通道激活速率变慢。上述结果表明TRPM2通道孔区选择性滤器在低等动物中并未形成闸门,而进化至高等动物比如人中则进化为通道闸门,首次揭示了TRPM2通道选择性滤器存在进化过程的物种差异性。
该研究不仅有助于解析TRPM2通道复杂的门控调节机制,加深对TRPM2通道介导的重要生理病理进程的理解,也为以TRPM2通道为靶点的药物研发提供新的分子基础。
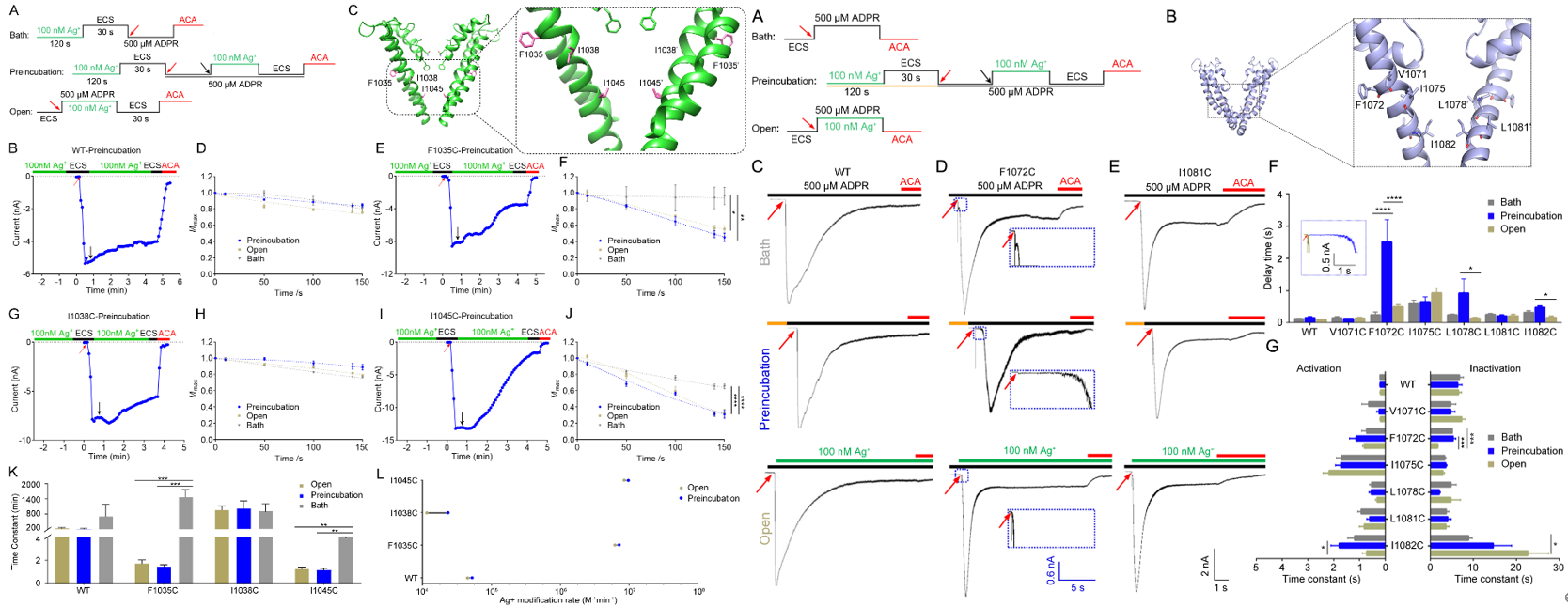
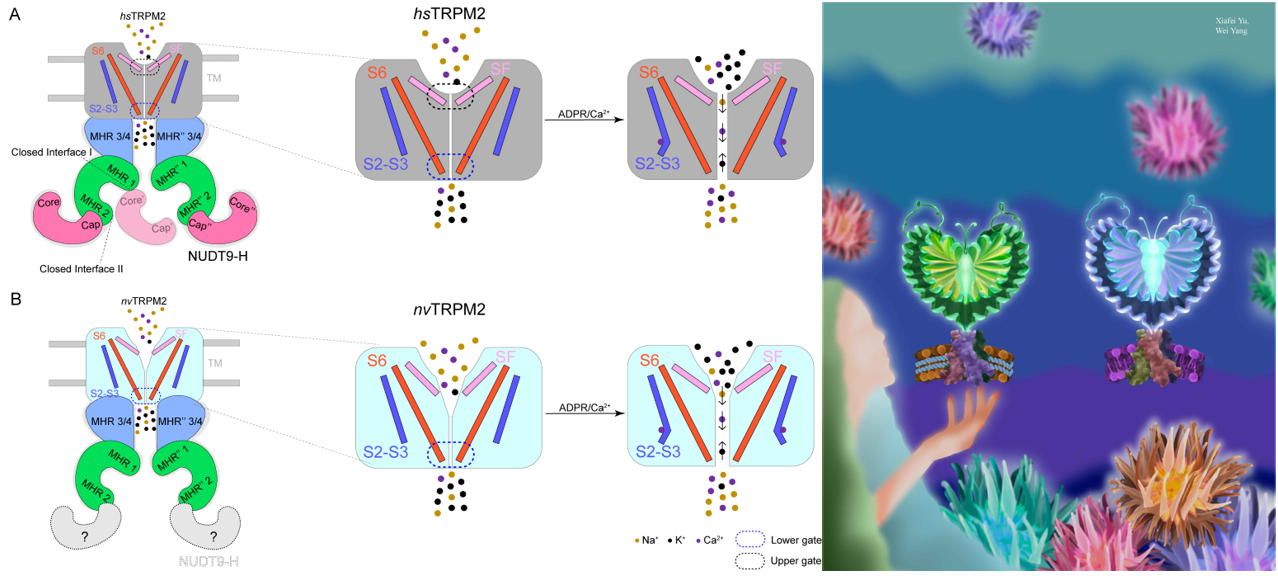
图3. 人源TRPM2 (hTRPM2) 和海葵TRPM2 (nvTRPM2) 的选择性滤器门控分子机制与功能在物种间的差异性示意图。(卡通右图:鹿琳博士)
该研究得到国家自然科学基金重点和面上项目、国家新药创新重大专项和浙江省自然科学杰出青年基金等项目的资助。杨巍课题组余夏飞博士、郭江涛课题组博博士后解媛博士、中国科学院深圳先进技术研究院/深圳理工大学张小康研究员和浙江大学医学院蛋白质平台马骋博士为共同第一作者,杨巍教授、郭江涛研究员和杨帆研究员为共同通讯作者。特别感谢聂焱副教授(上海科技大学)、张岩研究员(浙江大学)、张兴教授(浙江大学)、罗建红教授(浙江大学)、江林华博士(英国利兹大学)、常胜海博士(浙江大学)和黄丽(西湖大学)对本工作的支持,也感谢浙江大学和南方科技大学冷冻电镜中心,浙江大学医学院公共技术平台对本工作支持。
[1] Tóth, B., and Csanády, L. (2012). Pore collapse underlies irreversible inactivation of TRPM2 cation channel currents. PNAS 109,13440-13445.
[2] Wang, L., Fu, T.M., Zhou, Y., Xia, S., Greka, A., and Wu, H. (2018). Structures and gating mechanism of human TRPM2. Science. 362:eaav4809–35.
[3] Huang, Y., Roth, B., Lü, W., and Du, J. (2019). Ligand recognition and gating mechanism through three ligand-binding sites of human TRPM2 channel. eLife. 8:e36409.