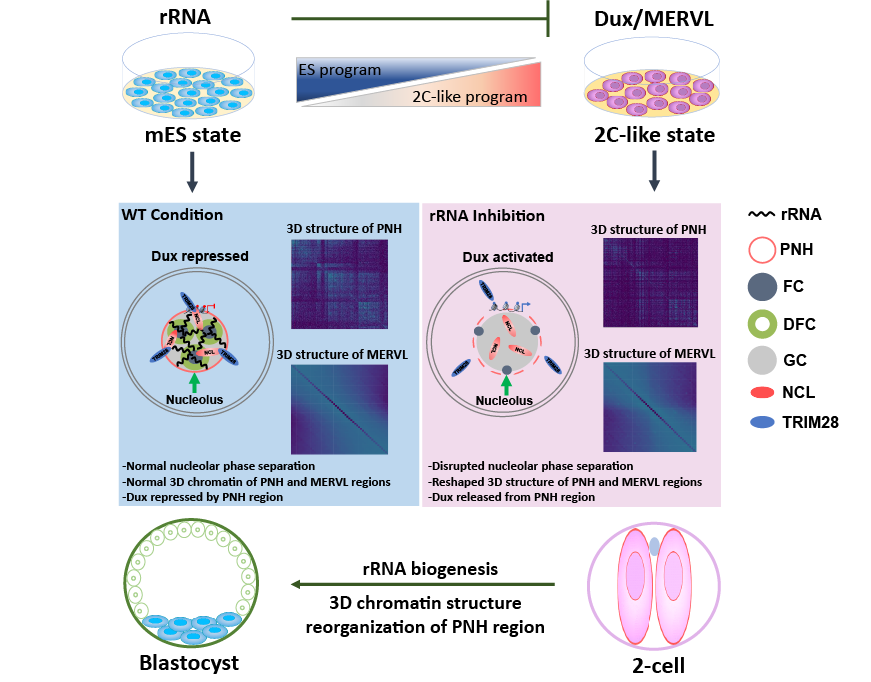
2021年11月9日,浙江大学医学院基础医学系干细胞与再生医学中心/浙江大学医学院附属第一医院/浙江省良渚实验室张进课题组在Nature Communications杂志上发表题为“rRNA Biogenesis Regulates Mouse 2C-like State by 3D Structure Reorganization of Peri-Nucleolar Heterochromatin”的研究论文,本研究通过多组学数据整合挖掘与分子实验相结合的研究策略首次发现核糖体RNA生物发生通过调控核仁相分离以及重塑核仁周边异染色质区高级结构来调控ES-2C-like细胞命运转变以及早期胚胎发育。多种抑制rRNA生成的方法可以诱发核仁应激(nucleolar stress),导致核仁周边异染色质的变化从而解除对Dux等2C基因的抑制,最终促进ES细胞向2C-like细胞的命运转变。
该研究是张进课题组在2021年7月31日Protein & Cell杂志上发表的题为“LIN28 Coordinately Promotes Nucleolar/Ribosomal Functions and Represses the 2C-like Transcriptional Program in Pluripotent Stem Cells”的研究论文的进一步拓展。这两项研究与张进课题组近期关于胚胎代谢(Nature Metabolism, 2021)和细胞周期对2CLC的影响(Stem Cell Report, 2021)的研究共同探索了传统被认为具有持家基因(housekeeping gene)功能的核仁、代谢等,在早期胚胎发育和细胞命运转变中的特异作用。

小鼠二细胞(2C)阶段胚胎细胞是胚胎发育早期阶段的全能性干细胞,可以产生胚胎和胚胎外组织的所有细胞类型。在体外培养的小鼠胚胎干细胞(ES)中,存在一小群分子特征与2C期胚胎的分子特征相似的2C-like细胞。最近研究表明,ES细胞向2C-like细胞的转变受到与表观遗传修饰相关的多种因素的调控[1,2,3]。染色质高级结构是重要的表观遗传因素,与基因表达调控和细胞命运转变密切相关。有趣的是,染色质高级结构似乎是2C基因调控和ES细胞向2C-like细胞转变的重要因素。例如,2C基因激活受到先驱转录因子Dux的调节,该因子可增加染色质可及性。最近的两项研究报道称,多能性因子DAPP2和DAPP4以及母源性因子NELFA可以与Dux的启动子区域结合并直接反式激活其表达[4,5]。此外,染色质结构重塑因子CAF-1的下调可以诱导ES细胞向2C-like细胞转变[6]。此前的研究表明定位于核仁的蛋白NCL,LIN28可以与TRIM28(KAP1)相互作用调控2C基因的表达[7,8]。然而,我们尚不完全了解核仁周边异染色质以及其高级结构如何调控ES细胞2C-like细胞转变。
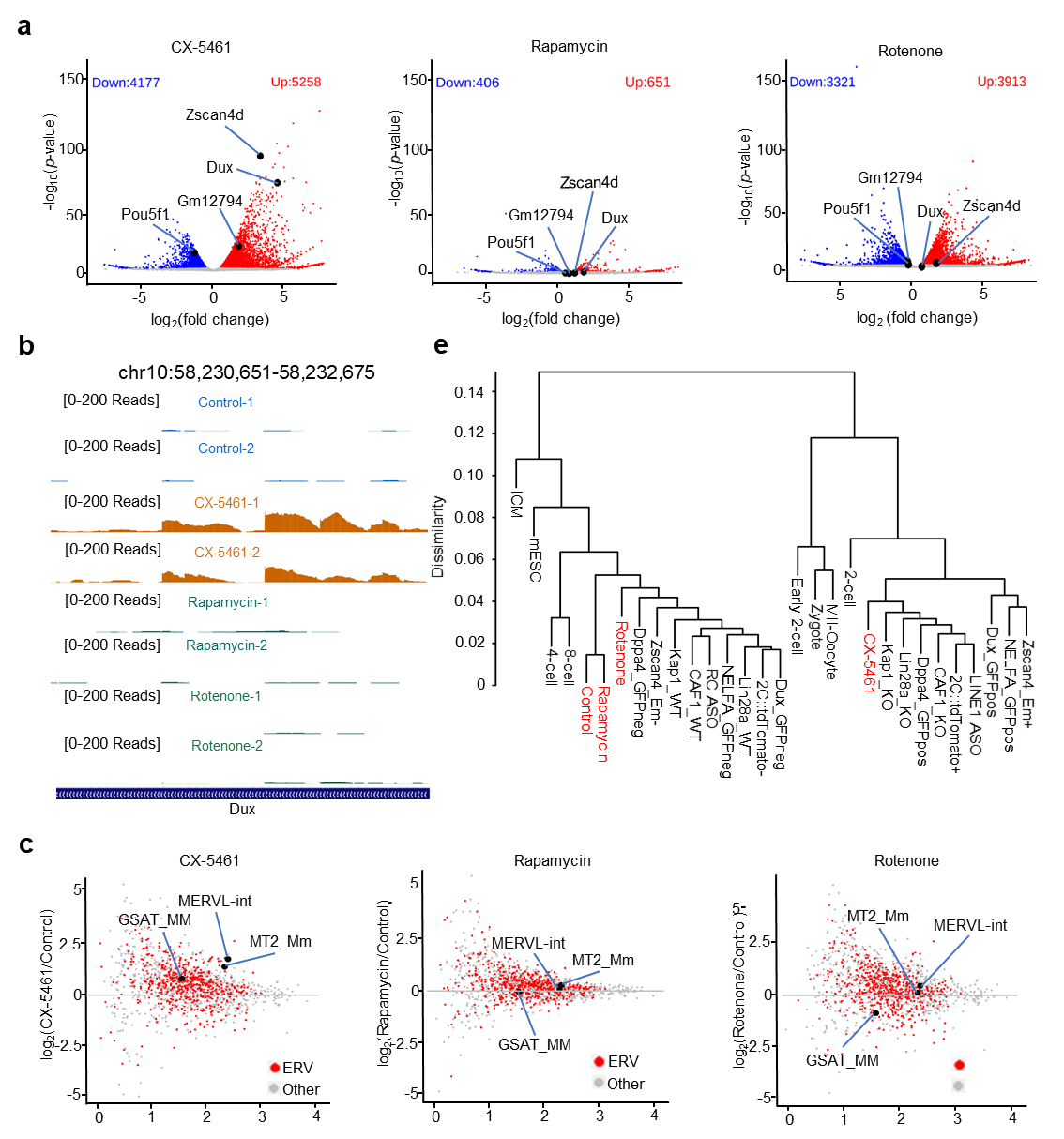
图1. rRNA生物合成抑制剂CX-5461处理激活2C基因
首先,我们发现rRNA合成抑制剂CX-5461处理ES细胞引起2C基因的高表达(图1)。rRNA生物发生在核仁相分离中发挥关键作用,我们进一步检测了CX-5461处理前后核仁相分离的变化情况,发现CX-5461处理影响了核仁正常相分离,关键蛋白NCL、NPM1以及RPA194介导的相分离液滴流动性明显增加,NCL和NPM1在核仁DFC层中形成的独特环形结构消失(图2)。
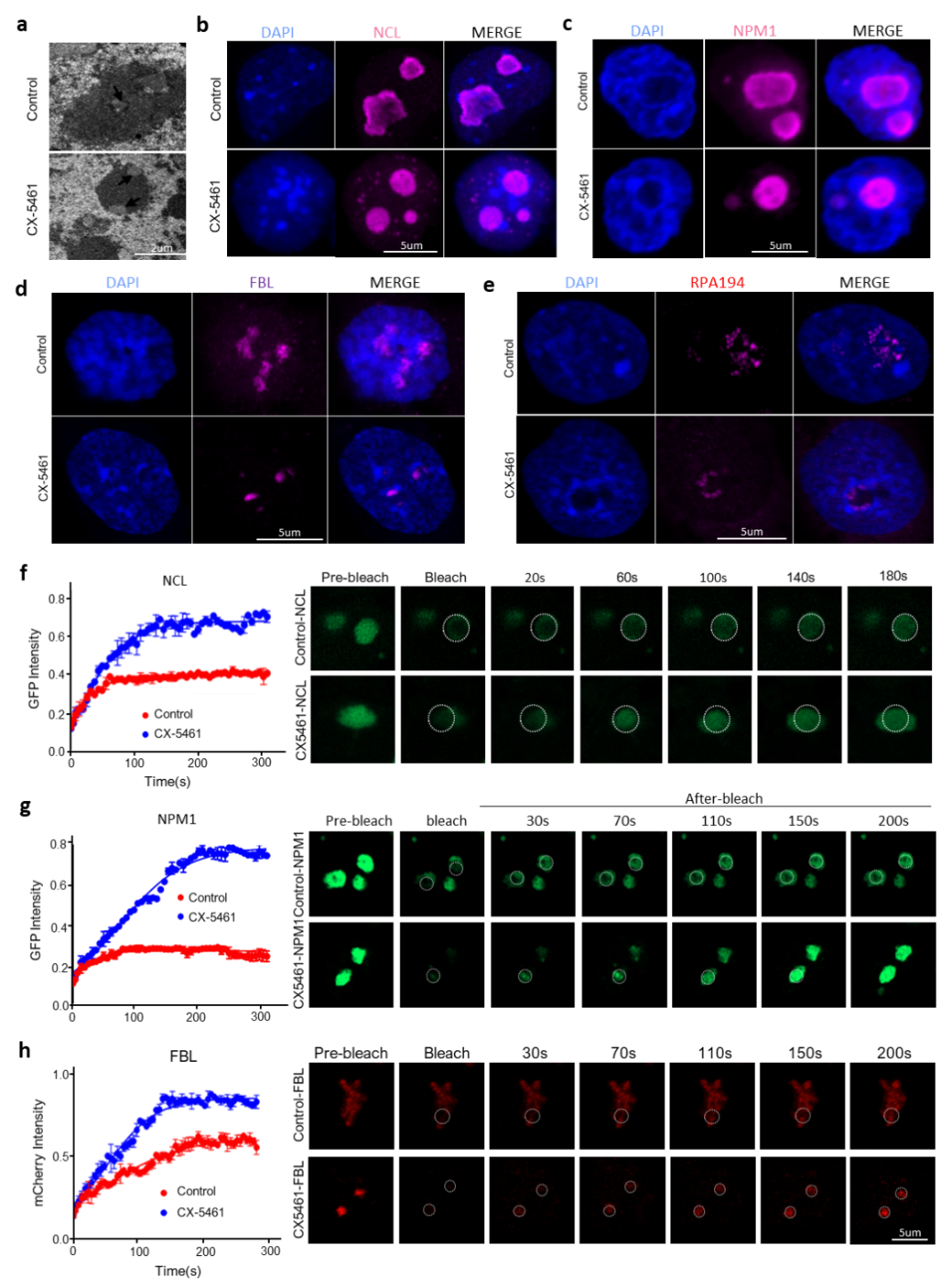
图2. rRNA生物合成抑制剂CX-5461影响了核仁正常相分离
相分离能够对染色质表观遗传状态进行调控,利用ChIP-seq和ATAC-seq测序实验,本研究进一步检查了CX-5461处理前后,核仁周边异染色质表观遗传状态的变化,发现CX-5461处理后,活跃性的表观修饰H3K4me3和H3K27ac水平明显增加,抑制性的表观修饰H3K9me3和H3K27me3水平明显降低(图3)。NCL/TRIM28复合物是ES细胞中维持核仁异染色质区的关键蛋白,NCL在核仁DFC层中形成的独特环形结构消失,提示我们CX-5461处理解除了NCL/TRIM28复合物对核仁异染色质区的结合,本研究进一步发现,CX-5461处理后,NCL/TRIM28复合物对核仁异染色质区的结合明显降低。
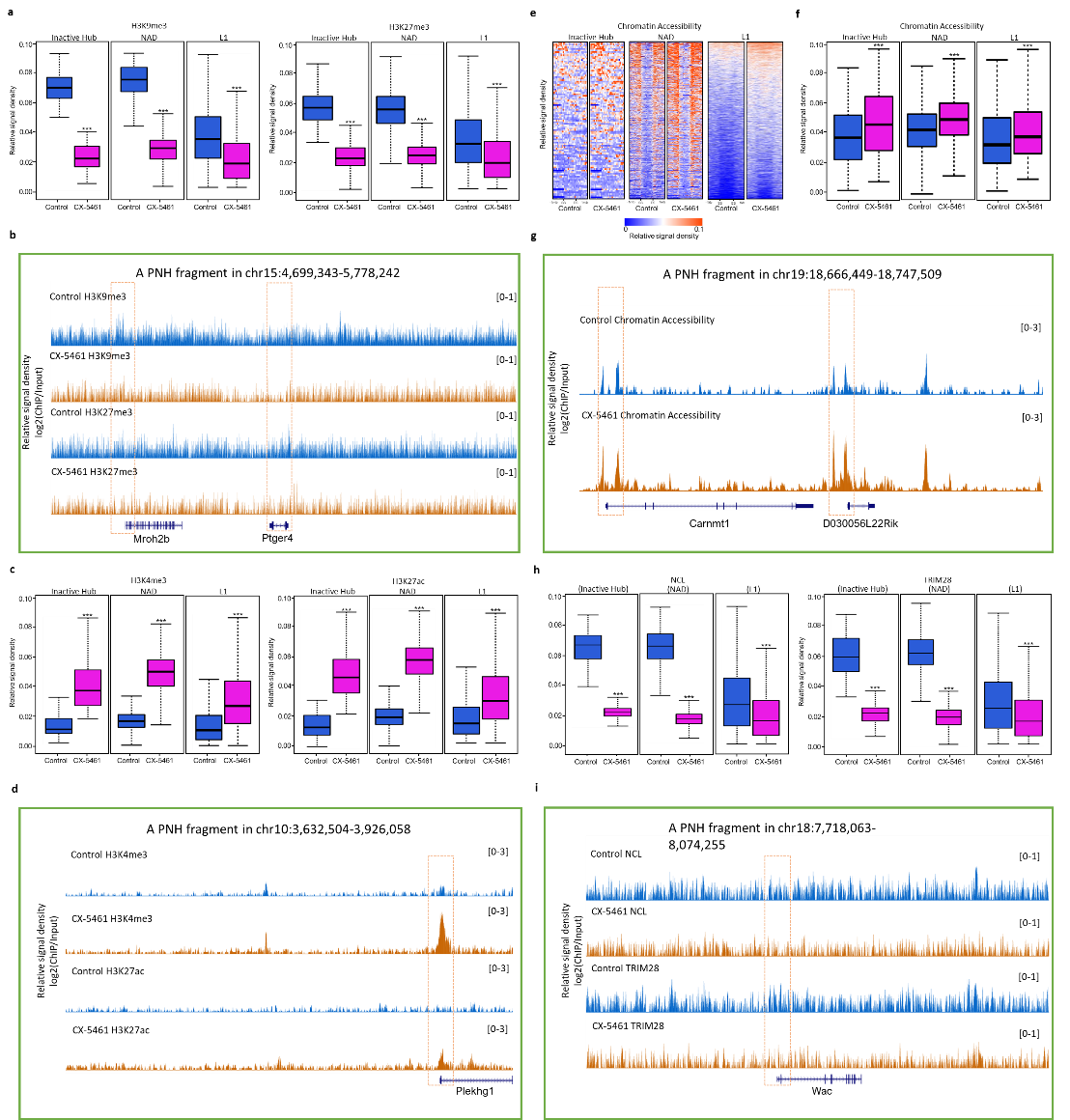
图3. rRNA生物合成抑制剂CX-5461干扰了核仁异染色质区的表观遗传状态
通过结合公开发表ChIP-seq、ATAC-seq、RNA-seq测序数据以及qPCR和ATAC-seq测序实验,本研究进一步研究发现rRNA生物合成抑制是通过关键转录因子DUX蛋白来激活2C基因(图4)。
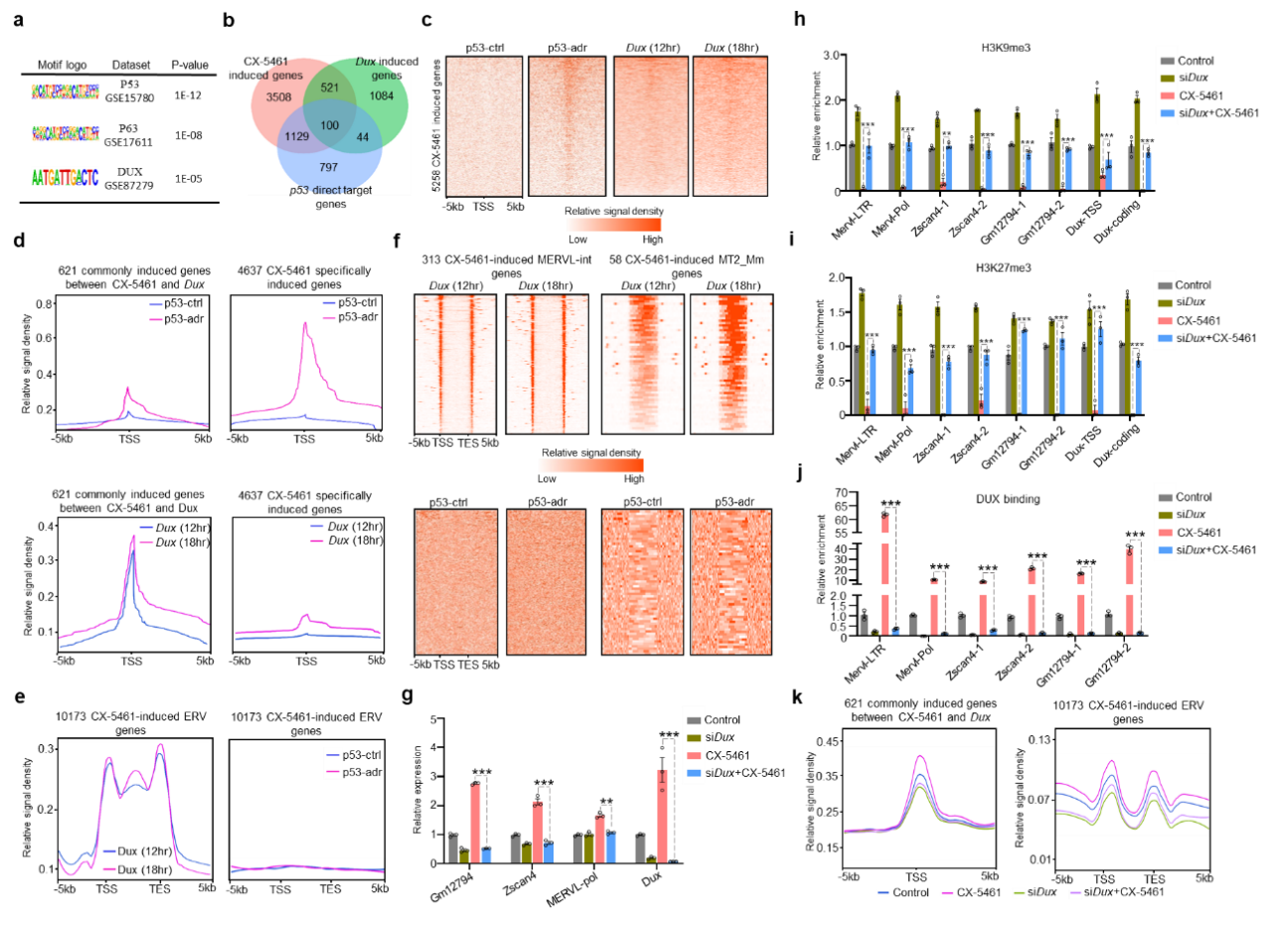
图4.DUX调控CX-5461处理诱导的2C基因激活
核仁异染色质区表观遗传状态的变化提示我们其染色质高级结构发生了变化,本研究进一步利用Hi-C测序技术解析了CX-5461处理前后ES细胞染色质高级结构的变化情况,发现CX-5461处理后,ES细胞核仁异染色质区和MERVL区域的3D基因组高级结构与2C胚胎更为相似(图5)。
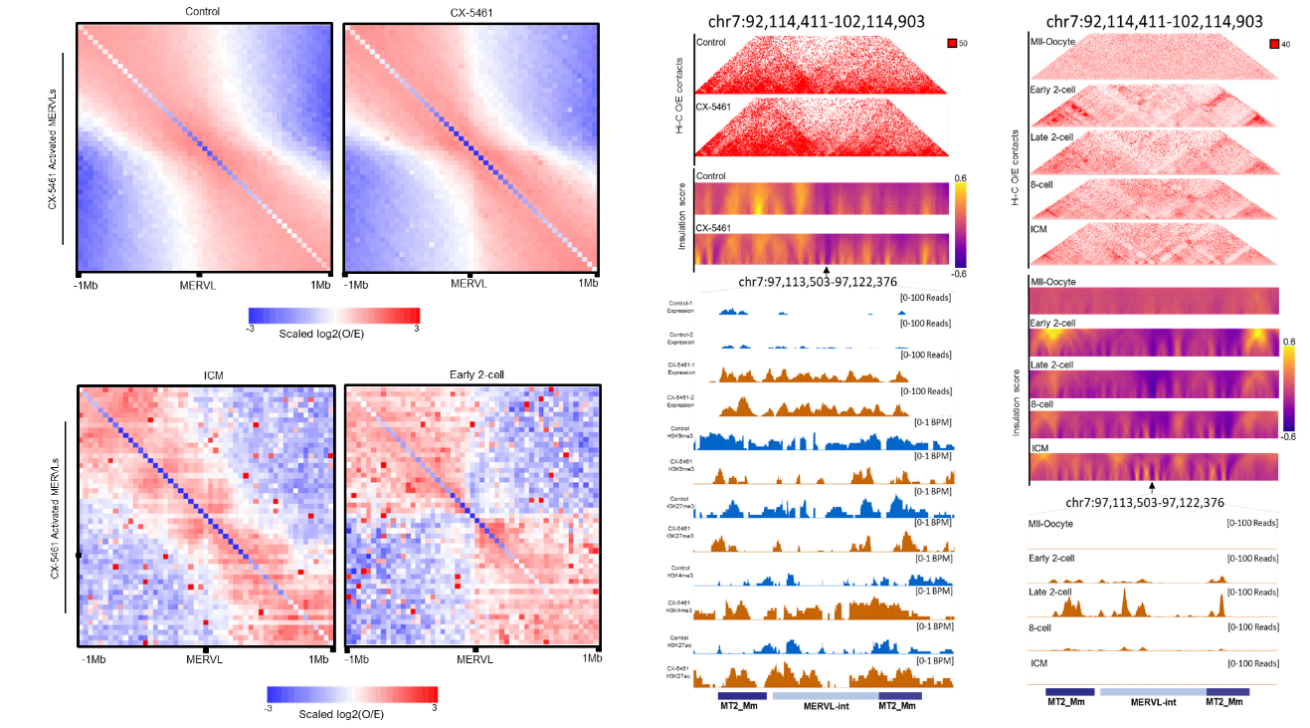
图5.CX-5461处理导致MERVL区域的3D高级结构与2C胚胎更为相似
在此基础上,本研究进一步通过细胞遗传学手段干扰rRNA生物合成,发现干扰rRNA生物合成过程中的步骤可以重现了CX-5461处理后的ES细胞分子表型(图6)。

图6. 细胞遗传学手段干扰rRNA生物合成重现了CX-5461处理后的ES细胞分子表型
最后,本研究利用CX-5461在小鼠早期胚胎上进行了实验,重现了ES细胞中的分子表型,有趣的是,研究发现rRNA生物合成是调控二细胞胚胎向四细胞胚胎转变的关键调控因素(图7)。

图7. rRNA生物合成是调控二细胞胚胎向四细胞胚胎转变的关键因素,CX-5461处理的小鼠胚胎重现了ES细胞中的分子表型
综上所述,本研究首次发现了rRNA 介导的核仁相分离和核仁周边异染色质的高级染色质结构能够调控ES细胞向2C-like细胞的命运转变;同时发现了rRNA生物发生是调控小鼠二细胞胚胎到四细胞胚胎转变的关键分子开关。本研究提供了一种将ES细胞重编程回2C-like细胞的潜在新方法,并加深了我们对干细胞命运决定和早期发育中核仁功能的理解。
该论文第一作者是浙江大学已出站博士后余华,科研助理孙振、博士生谭田雨以及科研助理潘鸿儒为本文的共同第一作者。本课题的研究得到了国家重点研发计划、国家自然科学基金面上项目、国家自然科学基金青年基金项目、浙江省杰出青年基金项目以及浙江省自然科学基金项目的支持,同时还得到了同济大学高绍荣课题组,北京大学李程、季雄课题组,浙江大学陈铭、钱鹏旭、许正平、盛静浩、沈力课题组,哈佛医学院George Daley课题组等国内外单位与课题组的支持。
张进课题组长期从事干细胞命运调控方面的研究,实验室成立以来作为通讯作者在Nature Metabolism, Cell Metabolism, Cell Stem Cell, Nature Communication, Protein & Cell, Journal of Hematology & Oncology, Genome Biology, Molecular Therapy, Stem Cell Report等杂志发表文章十余篇。实验室目前的研究方向包括早期胚胎发育和干细胞命运转变的调控机制,以及iPSC分化免疫细胞的转化研究。详细信息请见实验室网站https://person.zju.edu.cn/zhangstemcell。实验室在以上方向长期招聘博士后和特聘研究员/副研究员。如有意向加盟请联系zhgene@163.com。
【参考文献】
[1] Macfarlan, T. S. et al. Embryonic stem cell potency fluctuates with endogenous retrovirus activity. Nature 487, 57–63 (2012).
[2] Matsui, T. et al. Proviral silencing in embryonic stem cells requires the histone methyltransferase ESET. Nature 464, 927–931 (2010).
[3] Rowe, H. M. et al. KAP1 controls endogenous retroviruses in embryonic stem cells. Nature 463, 237–240 (2010).
[4] Eckersley-Maslin, M. & Alda-Catalinas, C. Dppa2 and Dppa4 directly regulate the Dux-driven zygotic transcriptional program. Gene Dev. 33, 194–208(2019).
[5] 17. Hu, Z. & Tan, D. E. K. Maternal factor NELFA drives a 2C-like state in mouse embryonic stem cells. Nat. Cell Biol. 22, 175–186 (2020).
[6] Ishiuchi, T. et al. Early embryonic-like cells are induced by downregulating replication-dependent chromatin assembly. Nat. Struct. Mol. Biol. 22, 662–671(2015).
[7] Percharde, M. et al. A LINE1-nucleolin partnership regulates early development and ESC identity. Cell 174, 391–405 (2018).
[8] Zhen Sun, Jin Zhang. et al. LIN28 coordinately promotes nucleolar/ribosomal functions and represses the 2C-like transcriptional program in pluripotent stem cells. Protein & Cell (2021).