肿瘤血管为肿瘤生长提供必要的氧气和营养物质,并为肿瘤的远端转移提供途径,是肿瘤微环境的重要组成部分。抑制肿瘤血管生成是抗肿瘤的重要策略之一,然而近年来,以抗血管内皮生长因子受体(Vascular endothelial growth factor receptor, VEGFR)为代表的抑制血管生成策略在肿瘤治疗临床实践效果远低于预期,亟需研究调控肿瘤血管形成的新机制。

2021年11月2日,浙江大学基础医学院柯越海/程洪强课题组在Nature Communications杂志在线发表了题为“Endothelial deletion of SHP2 suppresses tumor angiogenesis and promotes vascular normalization” 的研究论文。该研究利用血管内皮选择性基因敲除策略和多种小鼠肿瘤模型揭示了蛋白酪氨酸磷酸酶SHP2促进肿瘤血管生成和维持肿瘤血管非正常化特征的作用与机制。
蛋白酪氨酸磷酸酶SHP2介导生长因子等多条信号,调控肺、心脏和血管的发育和稳态。SHP2在多种肿瘤中高表达或者发生活化突变,是一个重要的促癌蛋白磷酸酶。由此发展了多种SHP2的别构抑制剂,这些抑制剂在临床前研究中具有显著抗肿瘤活性,且与其他抗肿瘤药物联合具有协同抗肿瘤作用,目前已有多个SHP2抑制剂进入临床研究。柯越海/程洪强课题组最新研究成果说明,SHP2抑制剂除直接作用于肿瘤细胞外,还可以通过肿瘤微环境,尤其是抑制肿瘤血管发挥抗肿瘤作用。
首先,在肿瘤细胞上清作用后的血管内皮细胞,以及肺癌组织血管内皮中观察到SHP2和磷酸化SHP2增加,表明SHP2发生活化。选择性敲除血管内皮SHP2的小鼠,皮下荷瘤和原位乳腺癌模型都显示显著抑制肿瘤生长。分析发现肿瘤血管减少,而血管正常化指标明显增加。这些观察明确了SHP2促进肿瘤血管生长和非正常化。
进一步,利用SHP2抑制剂,尤其是表达抗抑制剂SHP2突变(SHP2T253M/Q257L)的肿瘤细胞株的研究表明,SHP2抑制剂的抗肿瘤作用主要是通过肿瘤微环境实现的。
最后,通过筛选发现促血管新生转录因子SOX7在SHP2敲除和抑制的内皮细胞中表达下调。SHP2通过去磷酸化稳定ASK1,活化JNK-c-Jun信号轴调控SOX7的转录。病毒介导的SOX7表达显著逆转SHP2敲降或者抑制产生的内皮细胞功能改变,尤其是体内恢复SHP2敲除小鼠肿瘤的生长、血管生成和非正常化的特征。拯救实验结果说明了SOX7是SHP2调控肿瘤血管的一个关键下游分子。利用诱导敲除小鼠模型的优势,本文还证明了在长成的肿瘤中敲除SHP2同样具有显著的抑制效果。
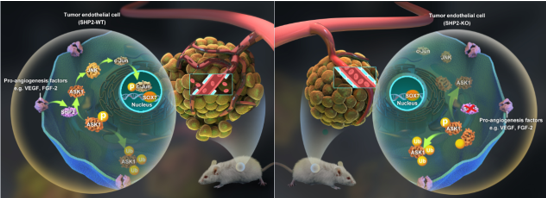
靶向抑制肿瘤血管内皮SHP2降低血管生成,促进肿瘤血管正常化,抑制肿瘤生长
蛋白酪氨酸磷酸酶SHP2通过去磷酸化稳定ASK1,增强促血管生成信号VEGF/FGF-ASK1-JNK-c-Jun-SOX7活性,促进肿瘤血管生成,同时调控肿瘤血管的非正常化。SHP2敲除和抑制显著肿瘤生长,破坏肿瘤血管生成信号,SOX7表达降低,肿瘤血管减少,而肿瘤血管非正常化特征,比如血管通透性,周细胞覆盖,血流和肿瘤组织缺氧等显著改善。因此靶向肿瘤血管SHP2可以抑制肿瘤,同时血管正常化可以提高传统抗肿瘤药物的抗肿瘤作用。
综上,该研究阐述了靶向血管内皮SHP2的显著抗肿瘤作用,为靶向SHP2抗肿瘤提出了新方向。柯越海教授、程洪强副教授为论文的共同通讯作者,浙江大学基础医学院徐志勇博士为论文第一作者,巴德年1701班郭纯逸参与研究并创作本文的机制图。该研究获得科技部重点研发计划和国家自然科学基金资助。