新冠病毒(SARS-CoV-2)利用其刺突(spike)蛋白识别宿主细胞受体(如ACE2),引起spike中的S1与S2结构域分离,触发S2结构域的构象改变,最终导致病毒与宿主细胞膜融合从而完成病毒入侵。但是,目前结构生物学研究发现新冠病毒spike结合ACE2受体时仅RBD结构域存在较大构象改变,其它部分只发生了细微的变化,并不足以触发紧密结合的S1和S2结构域分离。因此,新冠病毒spike结合宿主受体如何触发其S1和S2结构域的分离,进而激发S2膜融合蛋白机器,是冠状病毒入侵领域悬而未解的重要问题之一。
2021年08月31日,国际权威专业期刊《Cell Research》在线发表了题为“Mechanical activation of spike fosters SARS-CoV-2 viral infection”研究论文1,研究者通过生物力学理论计算,得到新冠病毒入侵过程中,病毒边缘单个spike/ACE2分子对受到10~30皮牛(1皮牛=10-12牛顿)级别大小的生物拉力;结合分子动力学模拟、单分子力谱技术及假病毒感染实验首次证明了生物力可以增强spike/ACE2相互作用并加速S1与S2结构域的分离,从而有利于病毒入侵宿主细胞。
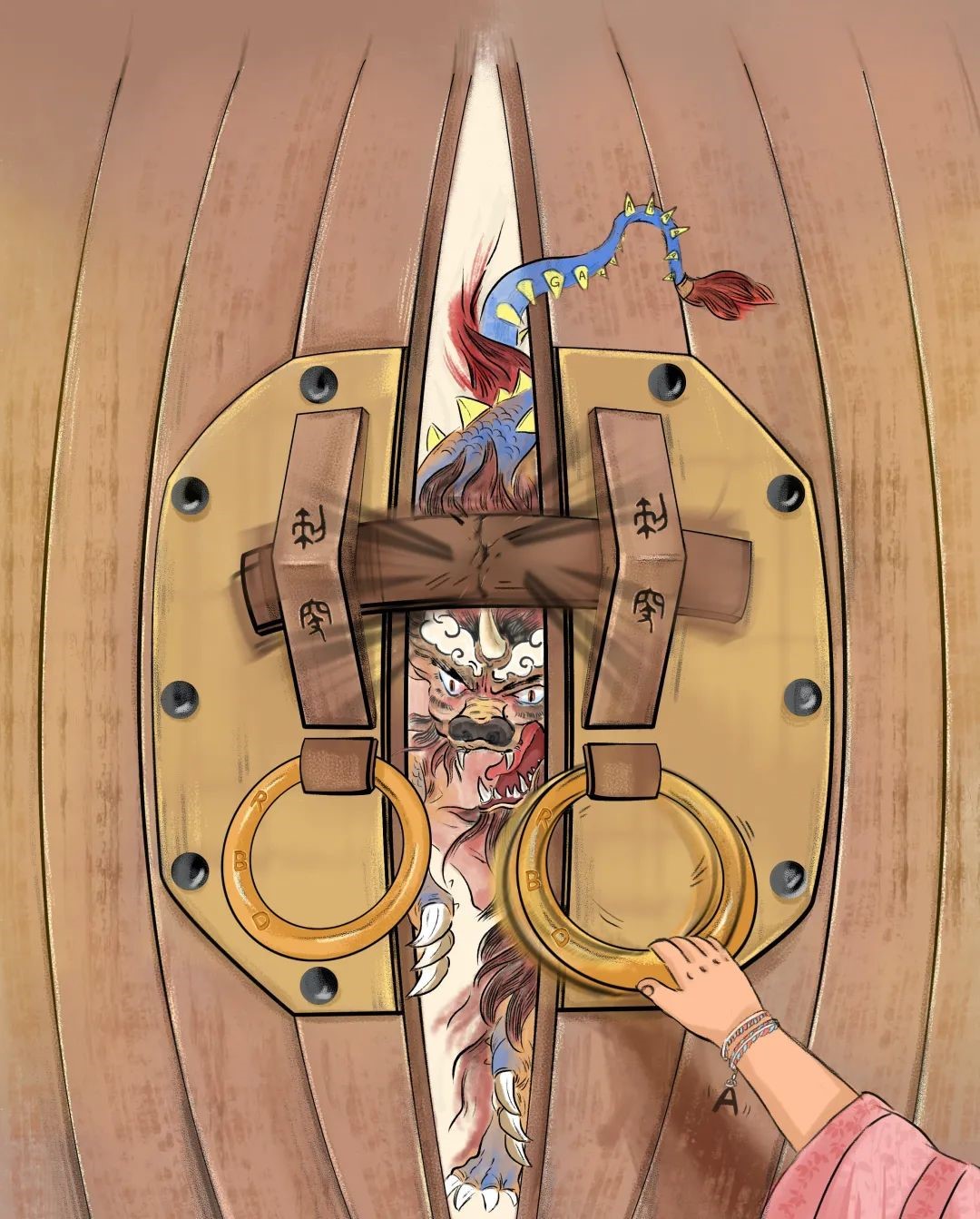
图1. 新冠刺突蛋白力学激活卡通图。SARS-CoV-2 RBD(门环)与ACE2(手)相互作用,生物力(小孩的手处于拉伸状态中)调控RBD与ACE2蛋白相互作用,且促使刺突蛋白发生构象变化(门栓即将破裂)。一旦门栓破裂(刺突蛋白构象变化完成),门外的猛兽(病毒RNA)就会进入(新冠病毒与宿主细胞融合,病毒RNA遗传物质进入宿主细胞)。
该论文揭示了生物拉力在新冠病毒颗粒通过spike/ACE2相互作用入侵宿主过程中的重要作用。病毒入侵过程中所产生的生物拉力能量主要源自于spike/ACE2互作所释放的一部分自由能。该能量进一步转换成为细胞-病毒系统的弹性势能。其主要包括两部分:1、细胞膜内存储一部分弯曲能,主要由相对柔软的细胞膜适应较硬病毒颗粒的形貌,包裹在其表面所储存;2、为保证病毒与细胞膜的紧密贴附,细胞-病毒接触面边缘的spike/ACE2分子键中存在着生物拉力,从而存储部分拉伸弹性势能。单分子力谱实验进一步证明新冠spike/ACE2相互作用在皮牛量级拉力作用下显著增强。分子动力学模拟显示,拉力将导致新冠病毒spike中与ACE2结合的结构域RBD发生转动,增强了spike/ACE2键的结合,延缓了它们的解离,从而增强病毒颗粒附着于表达ACE2细胞表面。而且,这种力学增强spike/ACE2互作效果在新冠spike上比非典病毒spike上更加显著,为新冠病毒比非典病毒更强的传染力提供了全新的分子机制解释。
更有意思的是,生物拉力还能成千倍地加速S1与S2结构域的分离(图2)。研究者还意外地发现了传染性较强新冠病毒突变株刺突上D614G的突变(该突变为阿尔法、贝塔、德尔塔、伽马及拉姆达毒株共有的突变)能够进一步3倍增强spike与ACE2受力结合,并35倍加速S1与S2结构域分离速率。该发现为解释D614G相关的高致病性毒株高传染性提供了全新的分子机制。
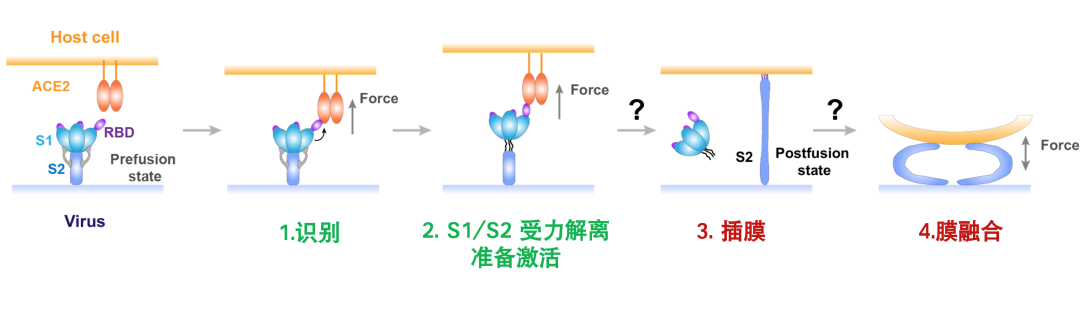
图2. 新冠病毒spike蛋白生物力激活的模型图及生物力加速导致新冠刺突蛋白S1与S2结构域分离的分子动力学模拟。
此外,该研究还鉴定了一种来自COVID-19康复患者的、具有较好中和能力的、同时结合S1与S2结构域的非RBD阻断的单克隆抗体,该抗体可以105倍抑制S1与S2结构域受力快速解离(图3)。基于上述研究发现,研究人员提出了一种全新的基于锁定刺突蛋白S1与S2结构域来中和冠状病毒的抗体筛选及设计策略,潜在性为目前新发的高致病性新冠突变毒株提供全新的有效阻断策略。
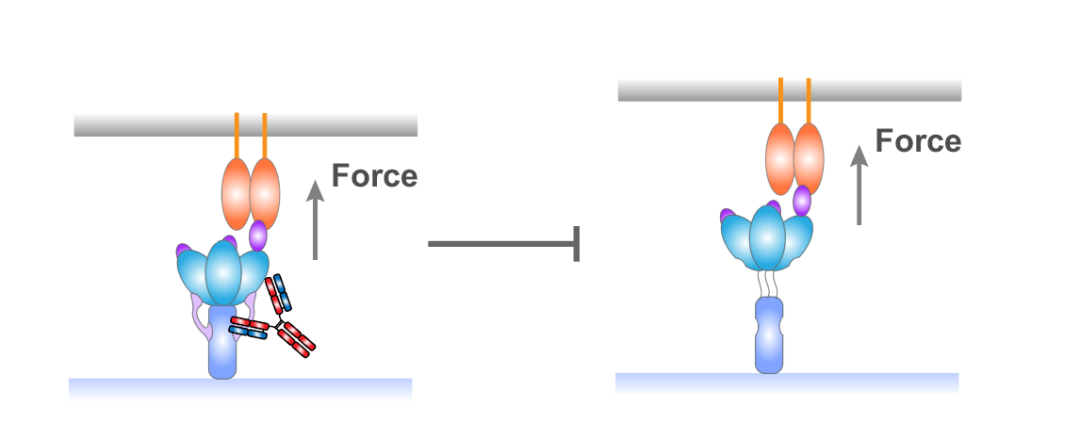
图3. 通过锁定S1与S2结构域的分离来中和新冠病毒的模型图
本研究是医工信交叉合作的又一个成功案例,是生物力学与力学生物学、单分子生物物理的一重要突破,也是陈伟和娄继忠课题组2020年Cell Research合作发现新冠包装机制2后又一个病毒领域的重要发现。该研究工作的共同第一作者包括浙江大学基础医学院博士后胡炜、合作单位的张勇博士、浙江大学机械工程学院博士研究生费攀宇(医工交叉)、浙江大学基础医学院/附属杭州市第一人民医院博士后张同同以及浙江大学基础医学院博士后姚丹梅。浙江大学基础医学院/附属第二医院陈伟教授、合作单位的娄继忠研究员、上海大学应用数学和力学研究所李振海教授和纽约大学王俊教授为共同通讯作者。阿里巴巴公益基金会、阿里云、浙大云和百度云为本研究提供了大量宝贵的高性能计算资源。该工作还得到了西湖大学周强教授、谢琦教授和山东大学王培会教授的重要支持,也得到了科技部国家重点研发计划、国家自然科学基金、浙江大学教育基金会新型冠状病毒肺炎应急科研专项(拼多多支持)等项目的大力支持。
实验室简介
陈伟教授实验室长期致力于研究物理因素动态调控蛋白质的分子机制,重点聚焦膜蛋白的配体识别和跨膜信号转导,并针对重大疾病开展创新药物研发。
实验室长期欢迎有志于交叉学科研究的学子(本科、硕士、博士、博士后等)加入!理、工、农、医各个背景均可。
实验室主页:
https://person.zju.edu.cn/jackweichen
参考文献:
Wei Hu, et al., Mechanical activation of spike fosters SARS-CoV-2 viral infection, Cell Research, 2021
Hui Chen, et al., Liquid–liquid phase separation by SARS-CoV-2 nucleocapsid protein and RNA, Cell Research, 2020