肠道的饱腹感是受神经系统调控的。在下丘脑富集的黑皮质素受体4(MC4R)被誉为大脑控制食欲和能量代谢的“总开关”。它通过响应人体多种能量代谢信号如瘦素、饥饿素和神经肽Y (NPY)等分子对下丘脑POMC和AgRP神经元的刺激,调节人体能量代谢和进食行为,是治疗肥胖症等代谢性疾病的热门靶点。黑皮质素受体家族属于A类G蛋白偶联受体,主要以激活G蛋白和阻遏蛋白等下游效应蛋白的方式进行信号转导。然而,该家族的五个成员氨基酸序列高度保守,识别相同或极为相似的多肽配体。目前靶向MC4R的上市药物,均为多肽类药物,对家族成员的选择性差,在激活MC4R增强患者饱腹感的同时也刺激MC1R,造成皮肤色素沉积等副作用,严重限制临床应用。因此,在靶向MC4R药物开发中,受体特异性是亟需解决的难题。
2021年8月25日,浙江大学基础医学院/良渚实验室张岩团队和中国科学院上海药物研究所/复旦大学王明伟团队在Cell Research上在线发表了题为“Structural insights into ligand recognition and activation of the melanocortin-4 receptor”的研究论文,围绕黑皮质素受体4进行了深入的结构与功能研究,结合多种药理学实验手段系统地阐明了黑皮质素受体的底物选择性机制,同时开展了结构导向合理化药物设计分析,为靶向黑皮质素受体家族的新药创制开辟新径。
研究团队采用单颗粒冷冻电镜技术,解析了MC4R与Gs蛋白复合物分别结合内源配体促黑激素MSH、两种上市多肽药物阿法诺肽(Afamelanotide)和布拉鲁肽(Bremelanotide)以及MC4R选择性小分子激动剂THIQ的高分辨率三维空间结构(3.0-3.1埃分辨率)(图1)。该研究不仅详细描述了MC4R被内源性多肽激活的分子机制,而且系统分析了多肽药物及小分子配体对受体激活的差异,有望为相关药物发现和结构优化提供精准信息。
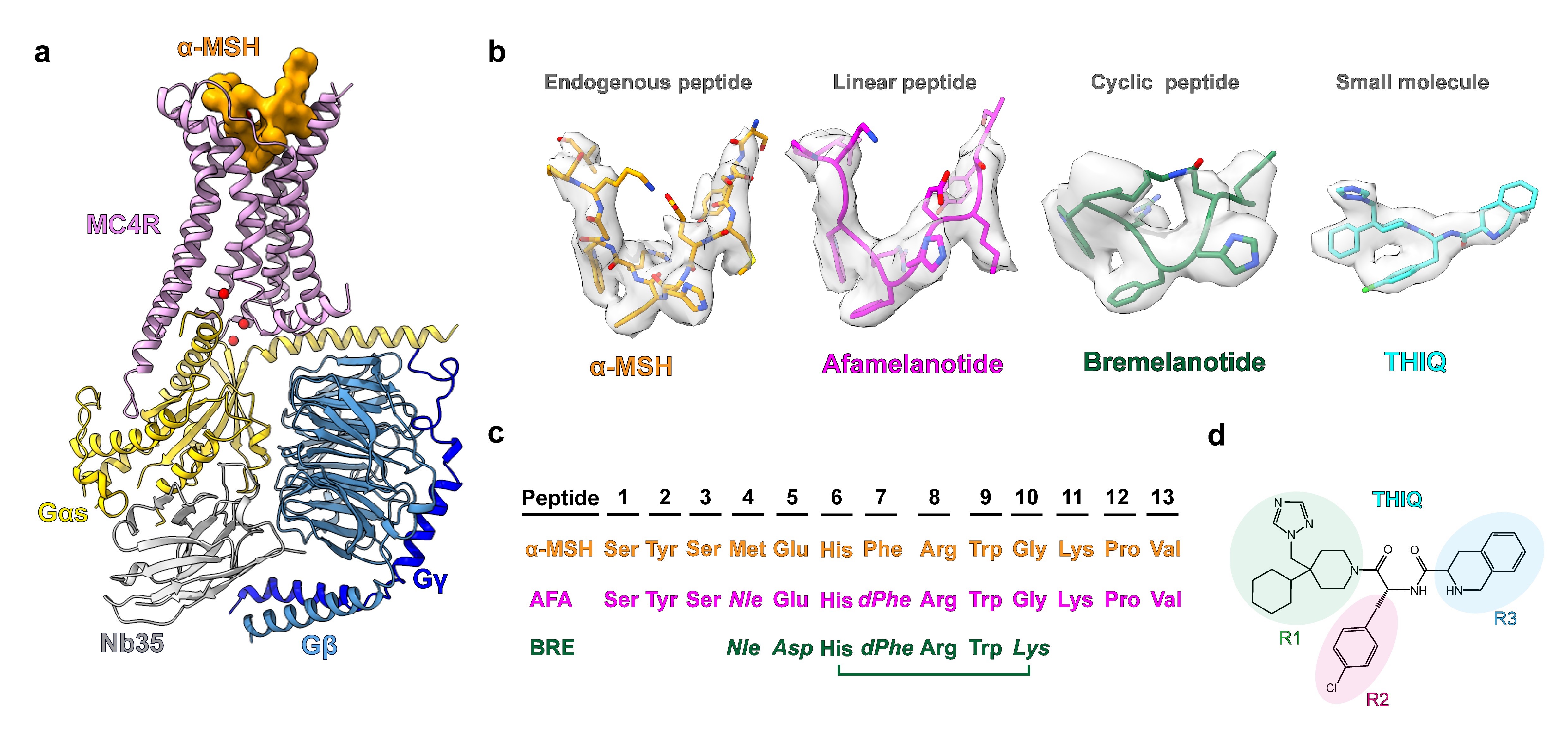
图1 多种配体与MC4R受体与Gs蛋白复合物结合的三维结构模型
MC受体家族配体结合口袋的氨基酸序列高度保守,除了MC2R,内源性配体和改造的多肽配体对其他4个MC受体几乎没有选择性。针对2005年由默克公司开发出来的对MC4R具有较高选择性的小分子配体THIQ,研究人员结合功能验证详细分析了这种选择性的结构基础(图2)。通过与MC1R同源建模结构叠合对比,他们发现,在两个受体中有3个氨基酸与THIQ的相互作用存在差异。随后,单突、组合双突和三突实验发现这3个氨基酸的整体组合对THIQ的选择性发挥了重要作用。此外,研究人员还发现了更多更集中的不保守氨基酸聚集区域,对选择性配体的研制具有指导意义。“相信我们对黑皮质素受体结构的解析将为开发毒副作用低和更为安全有效的减肥药物提供坚实的基础”,研究人员展望。
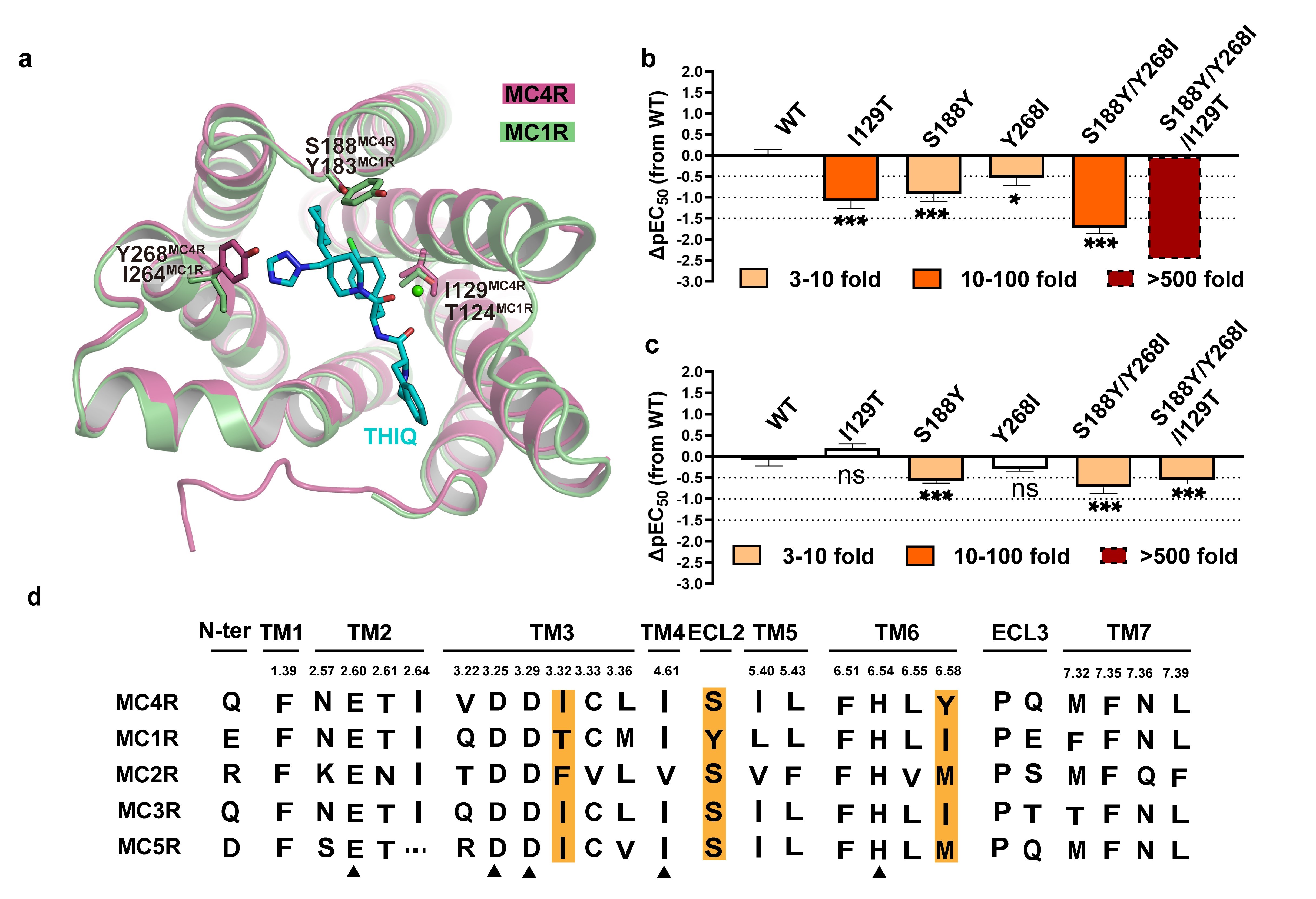
图2 黑皮质素受体结合配体选择性的结构基础
该研究得到国家自然科学基金委、浙江省自然科学基金委、教育部脑与脑机融合前沿科学中心等的资助。冷冻电镜数据收集在浙江大学冷冻电镜中心完成。浙江大学博士研究生张会冰、陈礼楠以及中科院上海药物研究所研究员杨德华为本文共同第一作者。张岩研究员和王明伟研究员为共同通讯作者。本项目的结构解析、配体激活差异、钙离子对不同配体激活能力的影响以及受体结合配体的选择性等实验在浙江大学完成;BRET和同位素配体竞争结合等实验在上海药物所完成。