抑郁症严重威胁人类的生命健康,全球超过3.5亿人正饱受抑郁症折磨,这种与应激和压力相关的情绪障碍疾病已经造成极高的致残率和自杀率,给社会和家庭带来巨大的经济负担和精神损失。近年来,研究发现氯胺酮在亚麻醉剂量下就可以起到快速且持续时间较长的抗抑郁作用让抗抑郁研究和抑郁症病人重燃希望。而氯胺酮是作为离子型谷氨酸受体N-甲基-D-天门冬氨酸(NMDA)受体的通道阻滞剂起到快速抗抑郁作用。
NMDA受体作为一种电压敏感的离子型谷氨酸受体,具有钙离子高通透特性,是兴奋性突触传递的关键分子。已知NMDA受体具有不同亚型,其中在前脑广泛表达的GluN2A和GluN2B两种亚型尤为受关注。越来越多研究表明NMDA受体GluN2B亚型在抑郁症中扮演十分重要角色,GluN2B选择性抑制剂能够显著减轻抑郁样行为,但其作用机制还不清楚。
2021年8月24日,浙江大学基础医学院杨巍和脑科学与脑医学学院罗建红团队在Cell Reports杂志在线发表了研究论文Disrupting phosphorylation of Tyr-1070 at GluN2B selectively produces resilience to depression like behaviors。文章揭示了内侧前额叶皮层(mPFC)NMDA受体GlN2B亚基酪氨酸1070位点磷酸化选择性调控介导抗抑郁样行为的新机制,为治疗抑郁症提供了新的思路。
研究人员前期研究已经发现GluN2B亚基的酪氨酸1070位点磷酸化能通过协同调控酪氨酸1472位点磷酸化进而阻止NMDA受体细胞膜内化的分子机制(J Biol Chem, 2015),但该调控机制的生理病理功能并不清楚。为此,研究人员运用CRISPR-Cas9技术构建了GluN2B Y1070F的遗传突变小鼠,采用系列行为学检测意外发现突变小鼠在基础水平及14天慢性束缚应激(Chronic restraint stress,CRS)暴露后均表现出显著抗抑郁样行为,而认知功能、焦虑、恐惧记忆、社交能力和探索等行为却没有变化,提示该突变小鼠选择性影响了小鼠抑郁相关行为。进一步研究发现突变小鼠选择性导致mPFC的GluN2B酪氨酸1472位点磷酸化水平降低,表现出了脑区选择性的调控作用。脑片电生理结果证明突变小鼠mPFC第5层锥体神经元的突触NMDA受体功能正常,但突触外GluN2B亚型NMDA受体功能显著下调,表明酪氨酸1070位点选择性调控非突触NMDA受体的细胞膜定位。相反,海马锥体神经元的突触NMDA受体和突触外NMDA受体均未变化,进一步明确该机制具有脑区选择性。随后,通过组合脑片电生理,生化和高尔基染色等手段,团队发现突变小鼠前额叶皮层的mTORC1活性显著增强,导致神经元兴奋性突触数量增加,从而产生了抗抑郁样行为。
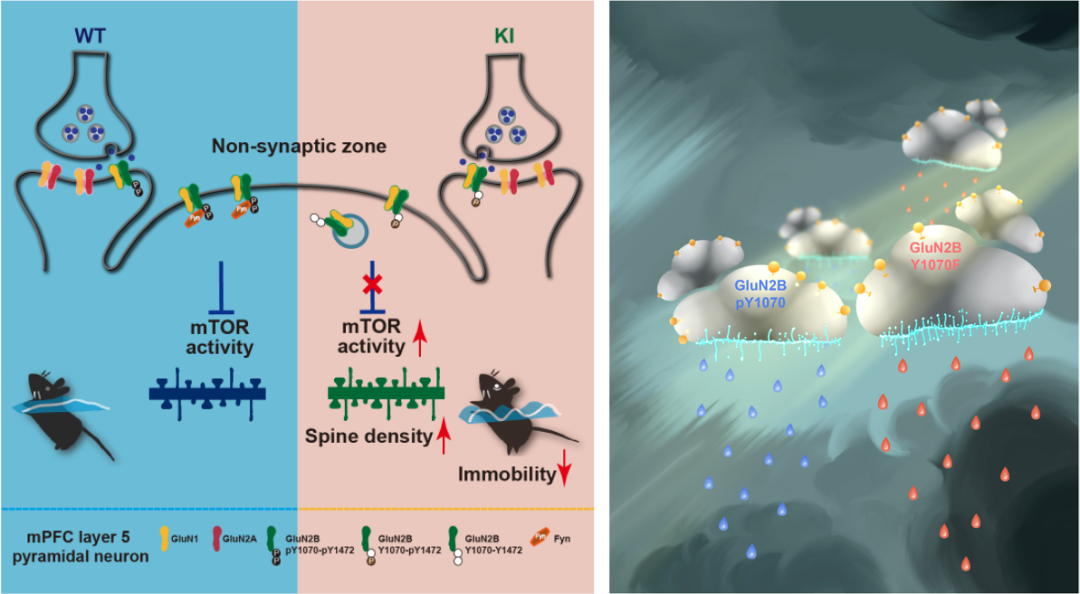
GluN2B的1070酪氨酸磷酸化选择性调控前额叶皮层锥体神经元兴奋性突触数目的卡通图(插画右: 鹿琳博士)
值得一提的是,尽管全球各大药企和科研机构均在围绕NMDA受体开发抗抑郁药物,但由于NMDA受体是大脑突触功能的关键分子,其药物研发一个瓶颈是会产生较大副作用。比如,前述的氯胺酮具有快速抗抑郁作用而备受关注,但由于它还具有成瘾性等副作用,制约了其临床应用。因此,该研究揭示了一种mPFC脑区NMDA受体酪氨酸磷酸化选择性介导抑郁症的新机制,有望另辟蹊径实现针对NMDA受体选择性干预抑郁症而不影响其生理功能,为针对NMDA受体靶标开发治疗抑郁症药物提供新的思路。
该研究得到国家自然科学基金重点项目、国家自然科学基金面上项目、广东省重点领域研发计划和浙江省自然科学杰出青年基金等项目的资助。师小芳博士为第一作者,杨巍教授和罗建红教授为共同通讯作者。感谢王晓东教授(浙江大学)、袁逖飞教授(上海交通大学)、唐逸泉研究员(复旦大学)对本工作的支持。
原文链接:https://doi.org/10.1016/j.celrep.2021.109612