2019年7月25日,浙江大学基础医学院/附属二院陈伟课题组、中科院生物物理研究所娄继忠课题组、清华大学生命学院和免疫所刘万里课题组合作在红斑狼疮疾病发病机制研究领域取得重要进展,在国际权威期刊《eLife》杂志上发表了名为“FcγRIIB-I232T polymorphic change allosterically suppresses ligand binding” 的论文。该论文从临床免疫科学问题出发,联合运用分子动力学模拟、单细胞生物物理学、分子原位动态检测技术、分子生物学等多学科研究手段,聚焦FcγRIIB-I232T变异体受体功能丧失的分子机制这一核心科学问题,提出了与红斑狼疮相关的单核苷酸多态性FcγRIIB-I232T跨膜域突变引起跨膜区构象变化,进而导致FcγRIIB-I232T胞外结构域构象状态改变,降低FcγRIIB-I232T与配体,IgG抗体分子(IgG1、IgG2和IgG3等)的相互作用,从而无法有效发挥其抑制功能的新机制。原文链接:https://elifesciences.org/articles/46689

系统性红斑狼疮(SLE)是一种复杂的自身免疫病,在中国人群总发病率约为70/10万。前人研究发现抑制性IgG受体FcγRIIB跨膜区的单核苷酸多态性I232T与系统性红斑狼疮的易感性呈正相关。在此基础上,清华大学刘万里课题组和北京大学人民医院栗占国课题组合作,对711位SLE病人临床症状与FcγRIIB-I232T进行了系统性的研究,发现携带FcγRIIB-I232T纯合基因的患者较携带杂合基因以及不携带此变异的患者具有更严重的SLE临床症状,表现为携带该SNP的SLE患者发病年龄更早,产生更多、更广谱的自身抗体,发生关节炎、贫血、白细胞减少、补体减少、血尿、白细胞尿和浆膜炎等器官受累的风险增加,疾病活动指数也更高。之前主要有两个不同模型来解释FcγRIIB-I232T抑制功能丧失的分子机制:跨膜区与脂筏相互作用能力的降低和跨膜区拓扑构象变化导致其布朗扩散速率的减慢。这两个模型都假定FcγRIIB-I232T不会改变膜外区与配体的相互作用。但是,目前没有直接的实验证据来证明这个前提假定。本次发表在eLife的论文中,研究揭示单核苷酸多态性FcγRIIB-I232T跨膜区在细胞膜中处于倾斜状态,并引起其胞外结构域取向发生变化而更贴近细胞膜从而对配体结合产生空间抑制, 导致其与配体,IgG抗体分子(IgG1、IgG2和IgG3等)相互作用的原位亲和力大大减弱,最终使得FcγRIIB无法有效地发挥其抑制性功能,表现出对系统性红斑性狼疮的易感性。
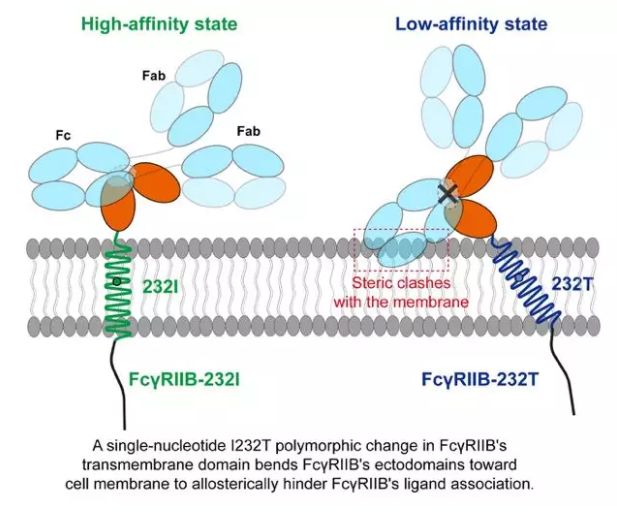
更重要的是,这一研究表明不同膜受体在细胞膜上可能倾向于选择不同的取向,而且同一膜受体的相对取向状态可能并不是单一的,且处于不同取向状态时配体结合能力存在差异。而且膜受体穿膜区的多态性变化或点突变能够影响膜受体膜外区与细胞膜的相对取向从而对膜受体的配体结合能力产生影响。这一现象可能对膜受体具有一定的普适性,提示我们可以从一个新的角度调控疾病相关膜受体的生物功能并产生相应疾病治疗的新方案。
这一研究成果为FcγRIIB-I232T增加系统性红斑性狼疮易感性提供了全新的理论解释,对系统性红斑狼疮疾病药物设计提供了新的方向。另外,该发现首次阐述了膜蛋白跨膜域单核苷酸多态性通过改变胞外域构象来影响其与配体相互作用的分子机制,为膜蛋白跨膜信号转导的研究提供了崭新思路。
陈伟教授在加入浙江大学医学院以来,研究团队重点聚焦膜蛋白构象动态变化和功能关系以及膜蛋白跨膜信号动态传导机制的研究。其利用生物力学、单分子生物物理、生物化学、分子生物学、细胞生物学、结构生物学以及计算生物学等多尺度的多学科交叉研究方法,对免疫细胞膜蛋白受体及神经突触粘附分子动态调控的分子机制进行系统深入的研究。自2014年回国独立工作以来,在Molecular Cell等国际顶级专业期刊上揭示生物力通过动态调控抗原呈递分子pMHC-I的构象变化来决定TCR的非我抗原识别,为未来寻找肿瘤新抗原以及基于新抗原的T细胞免疫治疗提供了基础理论和技术支持。而该论文的发表是陈伟研究团队对另一个重要免疫膜蛋白受体FcγRIIB配体识别机制及跨膜信号转导研究领域的新贡献,对红斑狼疮的药物开发提供了理论基础。
该研究获得国家科技部蛋白质重大研究计划项目、国家自然科学基金委、浙江大学等资金的大力支持。同时,感谢浙江大学医学部、工学部(机械学院等)、信息学部(生仪学院等)、浙江大学医工交叉研究生培养项目以及中科院多位教授的支持与帮助。浙江大学基础医学院博士研究生胡炜、中科院生物物理所副研究员张勇和北京大学人民医院副教授孙晓麟为该论文的共同第一作者,浙江大学基础医学院陈伟教授、中科院生物物理所娄继忠研究员及清华大学刘万里研究员为该论文的共同通讯作者。