2019年10月10日,浙江大学基础医学院,免疫学研究所汪洌课题组在《Science Advances》在线发表了“Epigenetic initiation of the TH17 differentiation program is promoted by Cxxc finger protein 1”论文,揭示了Cfp1通过控制 IL-6Rα表达调节Th17与 Treg的平衡,在自身免疫性疾病中有着直接的作用。
DNA甲基化和组蛋白乙酰化 /甲基化修饰等表观调控机制,被大量报道在T细胞亚群的功能分化中起着重要作用 。Cfp1(CXXC finger protein 1)于2000年被发现,是一个能与未甲基化的CpG岛结合的蛋白。由于未甲基化的 CpG岛通常代表着基因的转录处于活跃状态,因此 Cfp1的功能通常被认为与转录激活相关。汪洌课题组之前通过构建Cfp1条件性基因敲除小鼠研究发现Cfp1对于T细胞胸腺发育是必须的,缺失Cfp1会导致T细胞发育受阻,DP细胞大量减少。同时汪洌课题组还发现Cfp1对于巨噬细胞功能也是必须的,缺失Cfp1会严重削弱巨噬细胞的吞噬和杀伤细菌的能力。然而,Cfp1在辅助性T细胞中的功能依然不清楚。
通过构建在外周T细胞中敲除Cfp1蛋白的小鼠模型,我们发现Cfp1的缺失并不影响Th1和Th2亚群的分化,特异性的导致Th 17细胞分化受损并转分化为抗炎性的T reg细胞,从而增强模型小鼠对细菌感染的敏感性,并在体内免受自身性免疫疾病EAE的侵害。通过染色质免疫沉淀与高通量测序(ChIP-seq)分析结合,我们揭示了Th 17细胞中全基因组范围内的Cfp1结合位点以及与野生型相比Cfp1缺失后Th 17细胞中相关重要基因H3K4me3修饰的变化。我们发现Cfp1通过与IL-6Rα等重要Th 17细胞分化基因的结合维持其启动子区域的H3K4me3修饰。综上所述,我们的研究证实了表观调控因子Cfp1在Th 17细胞分化中的特异性正向调控作用,并调控IL-6Rα表达促使下游信号通路的激活,在自身免疫性疾病和细菌杀伤中起着重要作用。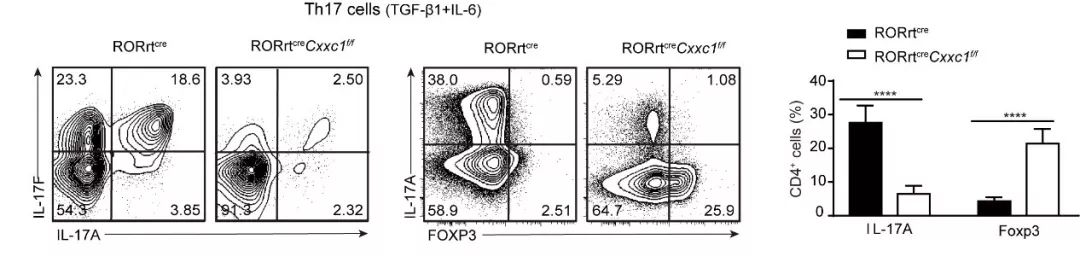
该研究第一作者为浙江大学免疫学研究所博士生林峰,孟晓瑜。其他合作作者包括本课题组郭奕鑫,曹文强等。汪洌教授为该研究的通讯作者,本研究得到广东中山大学眼科中心魏来教授、浙江大学第一附属医院血液研究中心钱文斌教授、浙江大学海宁国际校区刘琬璐教授、美国国立卫生院吴船教授以及浙江大学免疫所王建莉教授,鲁林荣教授,王迪教授课题组的帮助。此项研究得到了国家自然科学基金的支持。
论文链接:
https://advances.sciencemag.org/content/5/10/eaax1608
