肿瘤细胞中普遍存在蛋白质核质运输紊乱与蛋白定位异常的现象。核孔蛋白复合物与核转运蛋白在蛋白核质转运中起着重要的作用。目前关于肿瘤细胞中蛋白质异常核质转运机制尚不清楚。
2021年11月20日,浙江大学基础医学院病理学与病理生理学系张红河/来茂德课题组在Oncogene杂志上在线发表了题为“The interaction between S100A2 and KPNA2 mediates NFYA nuclear import and is a novel therapeutic target for colorectal cancer metastasis”的研究论文。
该研究阐明了S100A2蛋白与核转运蛋白KPNA2结合形成复合物调控转录因子NFYA的细胞核运输,NFYA通过抑制E-Cadherin的转录活性,促进结直肠癌的转移。靶向S100A2/KPNA2结合位点的特异性抑制剂delanzomib可以有效的抑制其对NFYA的转运从而靶向抑制结直肠癌的转移,为结直肠癌提供了一个新的治疗靶点和治疗方向。
通常分子量在35~40kd以上的货物蛋白需要与importin-α, importin-β和 RanGTP形成核转运复合物完成一个主动运输的过程。复合物进入细胞核后,货物蛋白从复合物中分离出来并与靶蛋白或核酸结合发挥其生物学功能。KPNA2是核孔转运蛋白importin-α家族中重要的一员。而S100A2蛋白源于S100家族,在先前肿瘤的研究其临床和生物学意义尚不清楚。S100A2作为一个分子量仅有11KD的蛋白分子,本可以自由穿梭于核质之间,无需核转运蛋白复合物的帮助。
在该研究中作者发现,结直肠核中S100A2高表达预后较差,且肿瘤侵袭前缘S100A2出现一个入核的现象。细胞学与小鼠转移模型均显示高表达S100A2可以促进结直肠癌转移。
通过进一步研究发现,S100A2通过与核孔转运蛋白KPNA2结合主动运输至核内,且在此转运过程中转录因子NFYA通过直接与S100A2结合,在S100A2/KPNA2复合物的作用下被转运至细胞核调控E-Cadherin的表达,从而促进结直肠癌的转移。
通过对S100A2/KPNA2关键结合位点在Drugbank数据库中进行药物筛选,发现delanzomib与KPNA2具有高亲和力,进一步体内体外实验证明delanzomib可以有效的抑制S100A2/KPNA2结合及NFYA的核转运抑制结直肠癌的转移。
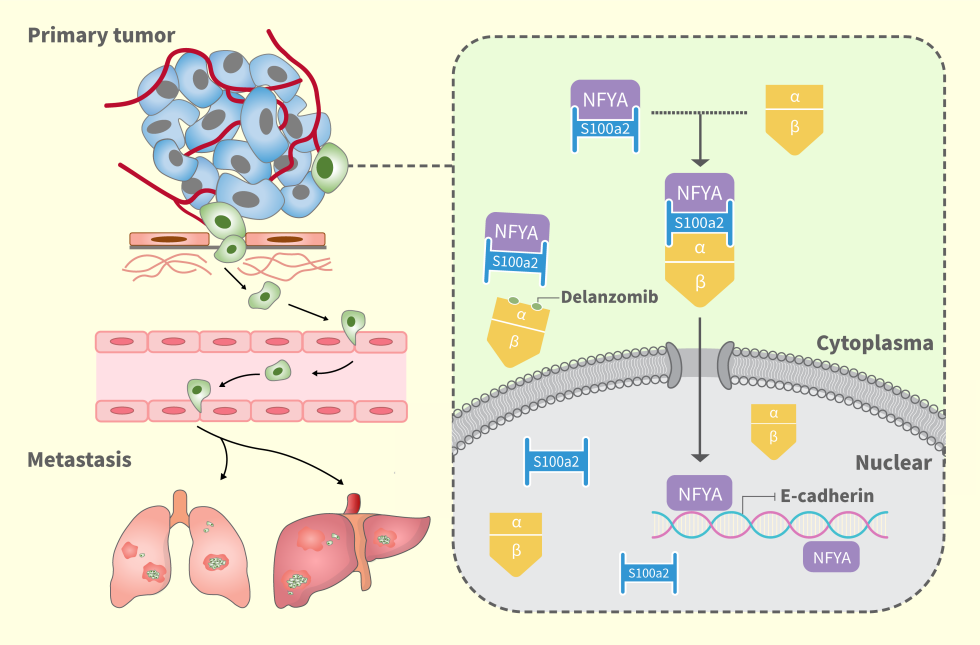
综上,该研究阐述了S100A2通过KPNA2的核转运及促结直肠癌转移的机制,为靶向S100A2/KPNA2复合物抗结直肠癌转移提出了新靶点。
张红河教授和来茂德教授为论文的共同通讯作者,浙江大学基础医学院博士后韩丰艳和中国药科大学博士生张蕾为论文的共同第一作者。项目受到国家自然科学基金和中国医学科学院医学与健康科技创新工程项目资助。
图文 | 张红河/来茂德课题组
编辑 | 郭静娴