半频哪醇重排(Semi-pinacol rearrangement, SPR)在立体选择性构筑复杂结构的天然产物中具有重要应用。目前仅在生物碱类天然产物生物合成中共发现了9个半频哪醇重排酶(Semi-pinacolase, SPase),且大部分酶属于单加氧酶家族。
asteltoxin是含二氧杂双环辛烷(2,8-dioxabicyclo-[3.3.0]-octane, DBO)结构的真菌毒素,具有抗肿瘤、抗病毒活性。据推测asteltoxin的DBO结构生物合成需发生SPR,该重排是发生在聚酮化合物上。但近50年来,催化其重排的酶及催化机制一直悬而未决。
浙江大学基础医学院毛旭明课题组在前期asteltoxin 结构类似毒素aurovertin的生物合成研究工作(J Am Chem Soc. 2015. 137:11904.)基础上,从asteltoxin的生产菌曲霉Emericella variecolor NRRL 2881基因组中鉴定到了负责asteltoxin生物合成的基因簇。
在证明asteltoxin、aurovertin前体环氧化聚酮骨架的合成路径完全一致的基础上,发现了环氧水解酶AstD是一个双功能酶,同时催化了环氧水解开环和紧接的半频哪醇重排。此外,研究还从数据库中检索到了另一个同源水解酶MrvD也具有SPR催化功能。
研究进一步通过蛋白shuffling、定点突变鉴定了AstD/MrvD催化水解和重排的关键氨基酸残基;并通过蛋白结构预测、密度函数计算、分子对接、动态模拟等方法发现AstD/MrvD催化了底物区域选择性5,6-环氧开环,以及聚酮骨架上碳碳键迁移。
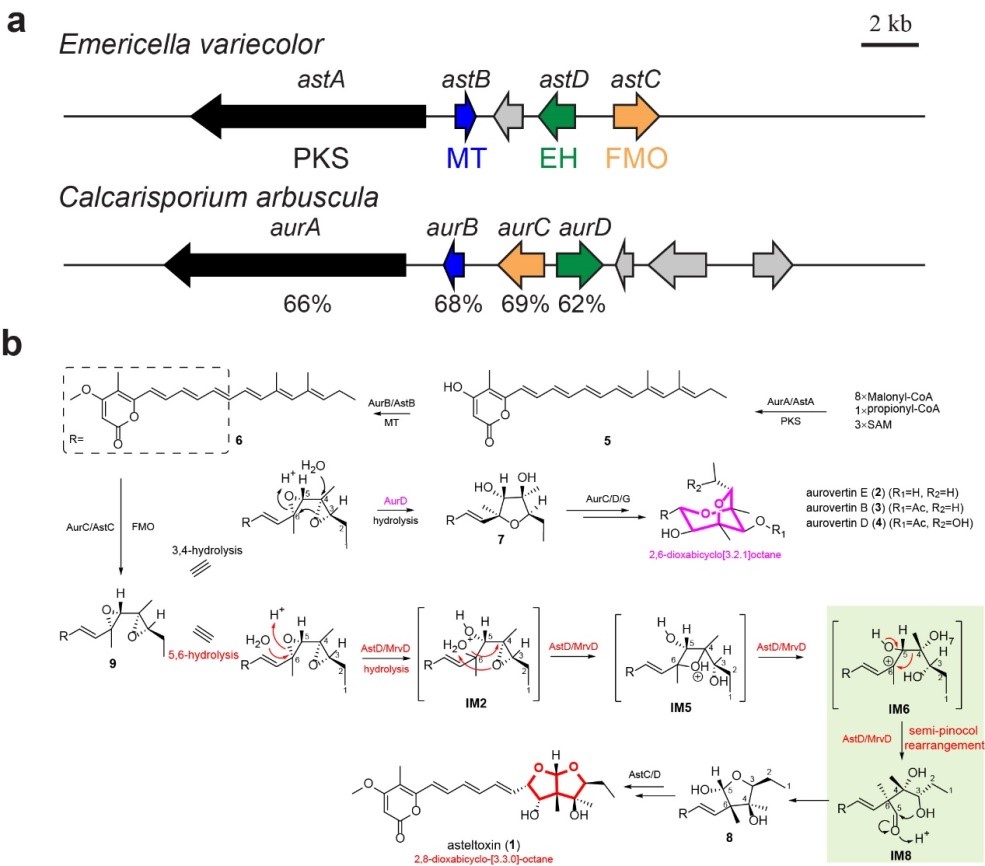
本研究基于asteltoxin的生物合成途径,发现了一种新的来自环氧水解酶家族的SPR能催化聚酮底物的碳链骨架发生重排,并且初步探究了其催化机制。本研究进一步拓展了人们对环氧水解酶功能的认识,也为新型SPase生物催化元件的开发,以及以环氧合成元件、聚酮链重排为基础构筑复杂多样天然产物奠定了基础。
以上工作于2021年11月23日以“Discovery of Semi-Pinacolases from Epoxide Hydrolase Family during Efficient Assembly of a Fungal Polyketide”在线发表于美国化学会期刊ACS Catalysis。
浙江大学基础医学院19级博士研究生曹菲为论文第一作者,浙江大学基础医学院毛旭明教授、上海交通大学石婷副研究员、浙江工业大学占扎君教授为共同通讯作者。本研究得到了国家自然科学基金、国家重点研发计划等项目的支持。
图文|毛旭明课题组
编辑|郭静娴