以吕宋肽菌素(luzopeptins)为代表的环酯十肽类(cyclic decadepsipeptides)微生物合成代谢产物具有C2对称性骨架结构。它们能以一定的构象嵌入到DNA双螺旋相邻的两个小沟中,具有良好的抗菌、抗肿瘤、抗病毒活性。前期研究已发现,吕宋肽菌素分子结构中的4-羟基-2,3,4,5-四氢哒嗪-3-羧酸(4-OH-Thp)结构单元是关键的药效团,其4-羟基上的乙酰化修饰对吕宋肽菌素生物活性起决定性作用。例如,双乙酰化的吕宋肽菌素组分A的抗肿瘤、抗菌活性最强,但抗病毒活性最弱,而去乙酰化的吕宋肽菌素组分C抗病毒活性最强,并且几乎没有细胞毒性。同时,吕宋肽菌素结构中的Thp单元也存在于其他的一些非核糖体肽类天然产物中,其稀有腙基(hydrazone)上的碳氮双键(C=N)可以引发肽链的β-转角结构,因此Thp也是一种很有应用前景的肽链结构砌块。然而,长期以来,吕宋肽菌素的生物合成机理,特别是Thp单元中腙基形成的生化基础一直是一个谜。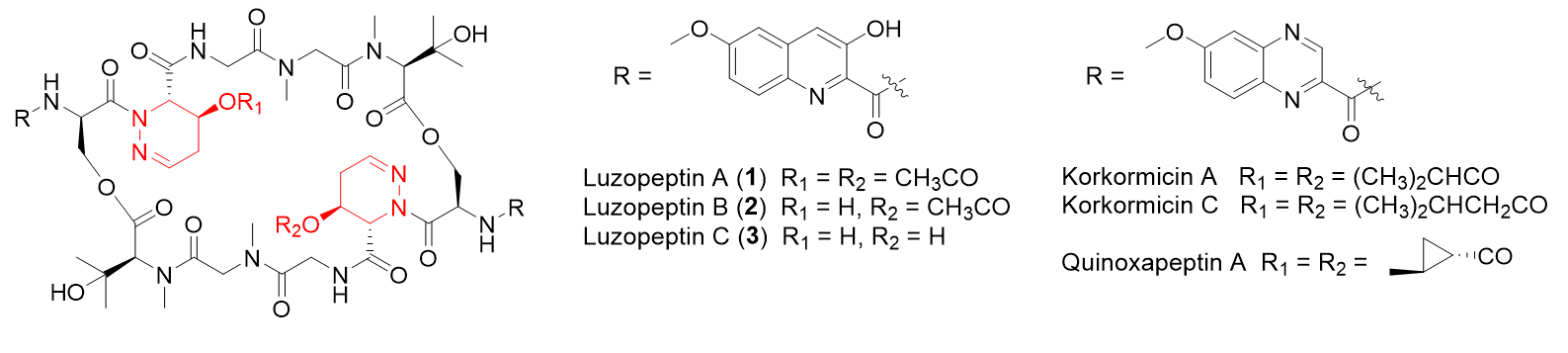
2021年6月27日,国际化学领域权威刊物《Angewandte Chemie International Edition》(《德国应用化学》)杂志在线发表了来自浙江大学基础医学院、浙江大学医学院附属第一医院杜艺岭课题组的研究论文“Enzymatic Tailoring in Luzopeptin Biosynthesis Involves Cytochrome P450-Mediated Carbon-Nitrogen Bond Desaturation for Hydrazone Formation”. 在这项研究中,研究者通过系统的基因敲除实验、代谢中间体或副产物(>15个)结构解析以及体外生化反应重构等实验,系统解析了马杜拉放线菌中吕宋肽菌素的生物合成机理,揭示了一类新的多功能细胞色素P450酶Luz26参与肽链后修饰过程中六氢哒嗪-3-羧酸(piperazate)单元的C-N键脱氢反应,形成腙基。此外,研究者还发现,对吕宋肽菌素生物活性起决定性作用的乙酰化修饰是由一个膜结合的酰基转移酶催化,通过体外酶学表征与定点突变实验,研究者推测这步反应是一个跨膜乙酰化过程,即乙酰辅酶A将乙酰基通过酶活性中心的跨膜孔道转移给已转运至胞外的受体吕宋肽菌素组分C。因此,这种将无细胞毒性的生物合成中间体先转移至胞外再修饰成活性终产物可能是一种细菌对自身产生的抗生素耐药的机制。
另外,鉴于C-N键的去饱和反应对于P450家族来说是非常稀有的反应类型,研究者进一步对其催化机理进行了探究。通过以P450酶Luz26为指导的数据库挖掘,研究者在江西伦茨氏菌(Lentzea jiangxiensis)的培养物中发现了一系列含哌啶酸结构单元的吕宋肽菌素类似物(江西肽菌素)。对该菌中Luz26的同源蛋白JxpK进行一系列体内与体外实验结果提示Luz26催化的C-N去饱和反应可能是先羟化后脱水的催化机理。
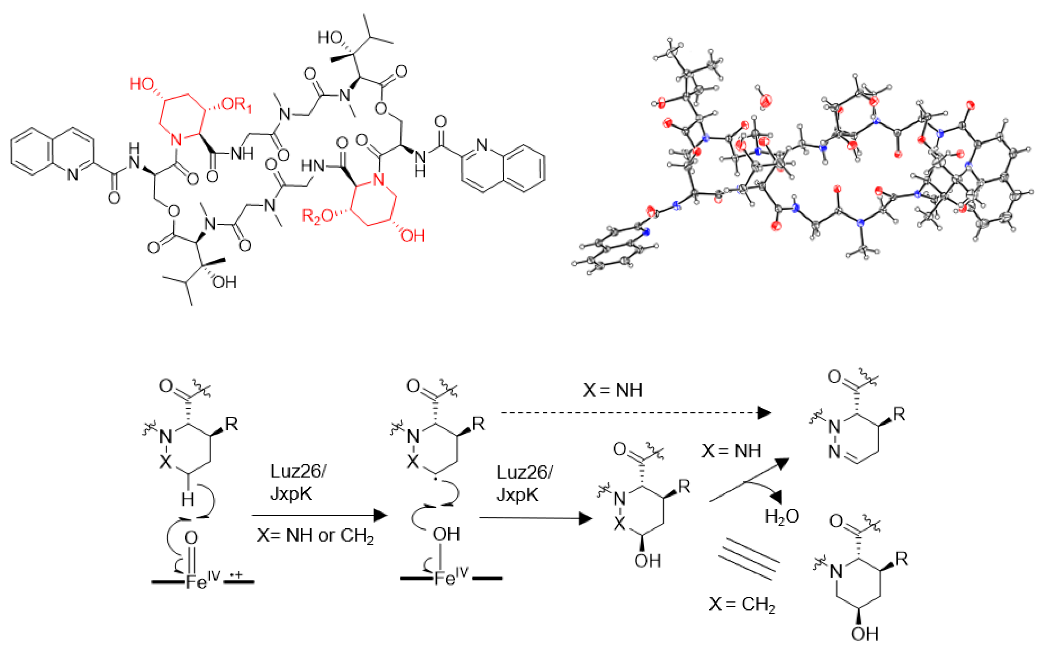
综上,该研究解析了吕宋肽菌素的酶促修饰过程,揭示了Thp结构的生物合成途径。Luz26的碳-氮单键脱氢活性拓展了细胞色素P450酶的催化功能,Luz27的跨膜催化提示了细菌对自身产生的抗生素耐药的新机理。此外,吕宋肽菌素生物合成基因簇的鉴定及类似基因簇的挖掘与产物鉴定为该类化合物今后的结构改造与组合生物合成奠定了基础。
本文的第一作者为浙江大学杜艺岭课题组的博士生施鑫杰和科研助理黄立明,通讯作者为杜艺岭。该工作受到国家重点研发计划合成生物学重点专项项目、国家自然科学基金委项目和浙江省自然科学基金项目的支持。
原文链接:https://onlinelibrary.wiley.com/doi/epdf/10.1002/anie.202105312