电压门控钾离子通道KCNQ家族在维持细胞兴奋性和离子平衡等生理过程中发挥重要作用。KCNQ2和KCNQ3可形成同源或异源四聚体,是形成神经元M电流的主要分子基础。KCNQ2或KCNQ3基因突变会引发良性家族性新生儿惊厥症,KCNQ2基因突变也会导致癫痫性脑病的发生。此外,神经元过度兴奋也会引发其他疾病如疼痛、帕金森病、局部缺血、精神分裂症等;调节KCNQ2是治疗这些疾病的一种潜在策略。因此,KCNQ2是一个与多种神经疾病相关的重要药物靶点。
许多小分子药物通过激活KCNQ2来达到治疗效果。瑞替加滨(Retigabine,RTG) 是第一个靶向KCNQ2通道治疗癫痫疾病的激动剂,2011年被批准使用,主要用于辅助治疗成人难治性癫痫部分性发作。RTG的结构类似物Flupirtine,在欧洲用于治疗急性和慢性疼痛已有数十年。然而,这两种药物由于选择性较差会对患者造成一定的副作用。另一种化合物ICA-27243,与RTG具有不同的作用位点,可选择性激活KCNQ2/3通道,并在癫痫模型小鼠中表现出抗惊厥活性。为了明确小分子药物在KCNQ2上的结合位点,揭示KCNQ2的配体激活机制,促进抗癫痫和镇痛药物的开发,2020年9月3日,浙江大学基础医学院郭江涛课题组和华东师范大学生命科学学院阳怀宇课题组在Cell Research上发表了题为Molecular basis for ligand activation of the human KCNQ2 channel的研究论文。该文章利用冷冻电镜技术解析了人源KCNQ2及其与小分子RTG和ztz240 (一种ICA-27243结构类似物)的结构,揭示了配体激活人源KCNQ2通道的分子基础。
作者首先解析了人源KCNQ2通道的结构(图1)。KCNQ2四聚体处于一种典型的域交换(domain-swapping)构象,通道中央是孔道结构域(pore domain, PD),周围是电压感受器结构域(voltage-sensing domain, VSD)。每个单体含有6个跨膜螺旋(S1-S6),S1-S4组成电压感受器结构域,S5-S6组成孔道结构域。该结构中孔道结构域处于关闭状态,而电压感受器结构域却处于激活状态。
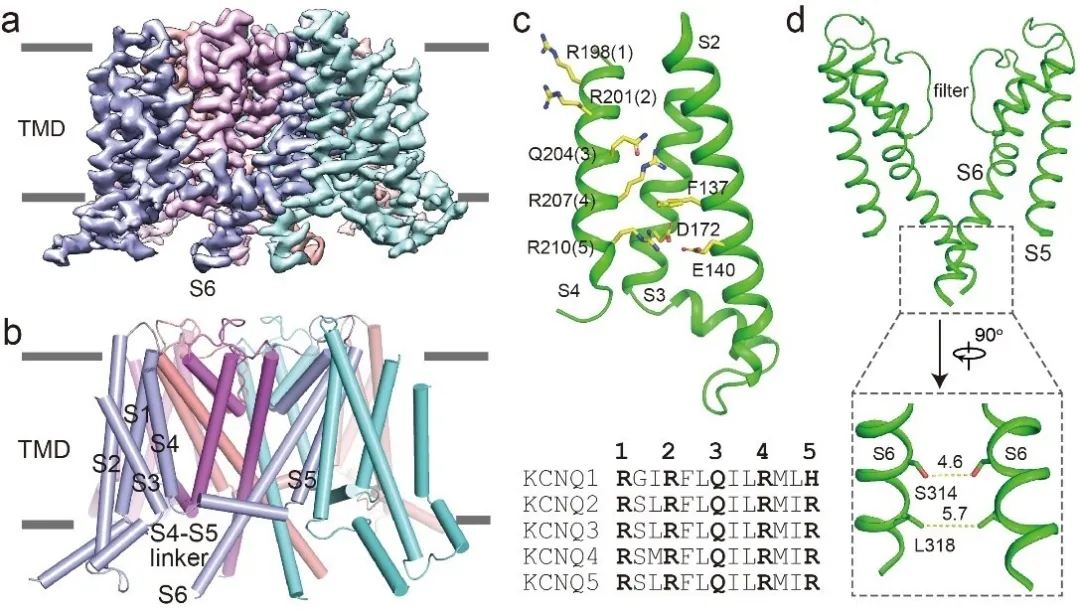
图1,人源KCNQ2通道四聚体结构。a,KCNQ2冷冻电镜密度图;b,KCNQ2卡通结构图;c,KCNQ2电压感受器结构域的结构和KCNQ家族S4的序列比对;d,KCNQ2孔道结构图。
随后,作者又分别解析了KCNQ2结合ztz240和RTG的结构,确定了两种小分子激动剂的结合位点,并提出了潜在的激活机理。在KCNQ2-ztz240结构中,ztz240位于电压感受器结构域中S3和S4之间的侧间隙,与电荷转移中心(gating-charge transfer center)直接相互作用;相互作用氨基酸包括S2的Phe137,S3的Asp172,S4的Arg207和Arg210等(图2)。电生理实验进一步验证了该结合位点。通过对比KCNQ2- ztz240与apo状态的KCNQ2的构象变化发现,ztz240像一个楔子一样插入S3和S4之间的疏水口袋,稳定了激活状态的S4的构象。从而推断,ztz240通过将电压感受器结构域维持在激活状态来激活KCNQ2。
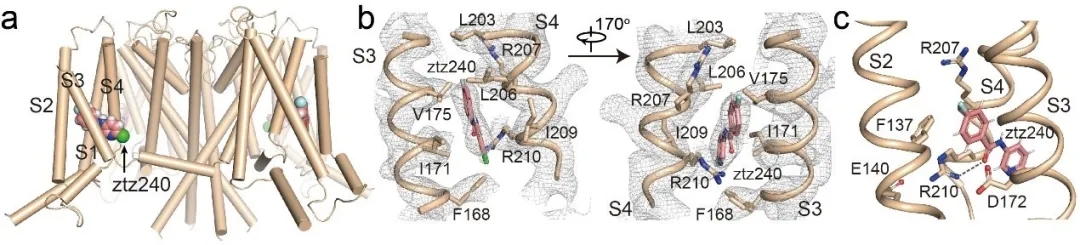
图2, KCNQ2结合ztz240的结构。a,ztz240在KCNQ2的位置;b,ztz240结合位点的局部电子密度;c,ztz240位于门控电荷转移中心。
与ztz240不同,RTG结合在孔道结构域侧面的S5、S6和相邻亚基的S6形成的疏水口袋中(图3)。除了疏水相互作用,RTG还与周围氨基酸形成氢键,其中S5上保守的Trp236对RTG的结合至关重要。RTG的结合位点也通过电生理实验进行了验证。RTG的结合主要引起KCNQ2在孔道结构域的构象变化;而电压感受器结构域却没有发生明显的变化,但较高的温度因子显示其具有更大的活动性。所以,与ztz240的激活机制不同,RTG在此起到变构调节的作用:与孔道结构域结合,但改变了通道的电压依赖性。
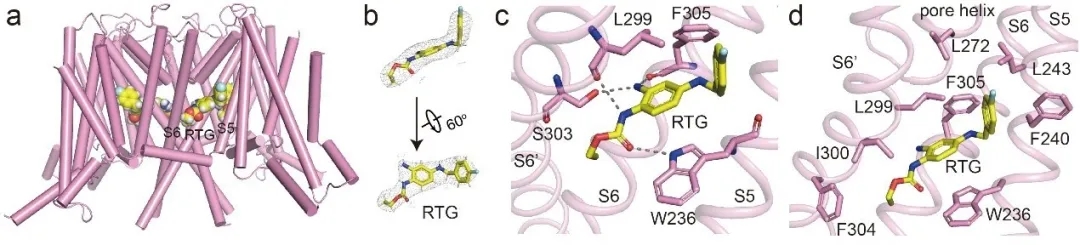
图3,KCNQ2结合RTG的结构。a,RTG在KCNQ2的位置;b,RTG的电子密度;c,RTG与其周围氨基酸残基之间的氢键(虚线);d,RTG与其周围氨基酸残基之间的疏水相互作用。
此外,通过质谱分析,作者发现KCNQ2可与内源性钙调素(CaM)形成复合物。作者进一步解析了KCNQ2-CaM复合物的低分辨率电镜结构。在胞内区,KCNQ2的胞内螺旋HA、HB被钙调素紧紧包裹,四个HC螺旋形成一个卷曲螺旋(coiled coil)。与之前解析的KCNQ1-CaM复合物相比,KCNQ2-CaM的HA和HB的走向发生变化,两个相邻亚基的HA-HB-CaM结构域彼此分开,而它们在KCNQ1-CaM中却直接相互作用。
本研究解析了KCNQ2与ztz240和RTG复合物的结构,明确了ztz240和RTG的不同结合位点,并探讨了两种配体激活KCNQ2的分子机制。在目前止痛和抗癫痫药物存在副作用的情况下,两种激动剂在不同结合位点的识别将有助于未来药物的开发和优化。
浙江大学基础医学院2018级博士研究生李潇潇、华东师范大学生命科学学院张乾森副研究员和郭佩佩博士研究生为本文共同第一作者。天津大学叶升教授参与了本研究工作。本研究的电镜数据收集得到浙江大学冷冻电镜中心的大力支持。浙江大学基础医学院郭江涛和华东师范大学生命科学学院阳怀宇为共同通讯作者。