在炎热的夏日,来上一杯冰爽的薄荷饮料别提多爽快了;在昏昏欲睡的时候,嚼一颗薄荷口香糖也很提神醒脑。在薄荷中,引起清凉感觉的主要化学成分是薄荷醇 (menthol) [1];而在动物体内,Transient Receptor Potential melastatin 8 (TRPM8)离子通道是薄荷醇的主要受体[2, 3]。该通道可以被薄荷醇打开,进而引起动作电位,让人产生凉爽的感觉。虽然TRPM8通道与数个人工激动剂、抑制剂结合状态的高分辨率三维结构已经得到解析[4-6],但是其天然激动剂薄荷醇是如何结合并激活该通道的分子机制一直未被阐明。
2020年7月29日,来自浙江大学基础医学院生物物理学系的杨帆课题组、杨巍课题组和东北林业大学的杨仕隆课题组在Nature Communications杂志上发表研究论文 “Molecular mechanisms underlying menthol binding and activation of TRPM8 ion channel” 来探索上述机制。

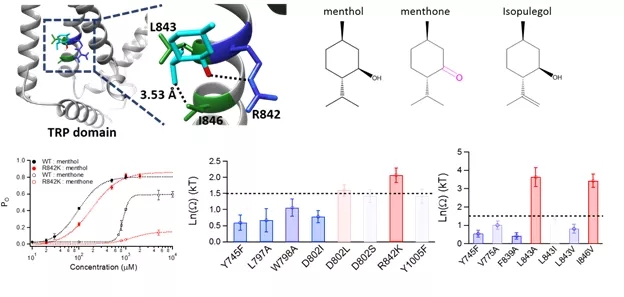
该论文首先通过基于TRPM8通道结构的分子计算对接,预测了薄荷醇与TRPM8通道的一系列相互作用。研究人员进而在预测的TRPM8的配体结合口袋里引入了一系列氨基酸点突变,通过基于电生理膜片钳记录的双突变循环实验策略,得到薄荷醇、薄荷醇类似物和TRPM8突变体之间的结合能。电生理实验结果与分子对接结果相吻合,即薄荷醇通过 “grab and stand”机制与TRPM8通道结合,即薄荷醇的羟基像“手”一样,通过氢键“抓紧”TRPM8的第四个跨膜区(S4)上的R842位点;而薄荷醇的异丙基像“脚”一样,通过范德华力“站在”L843和I846位点上。
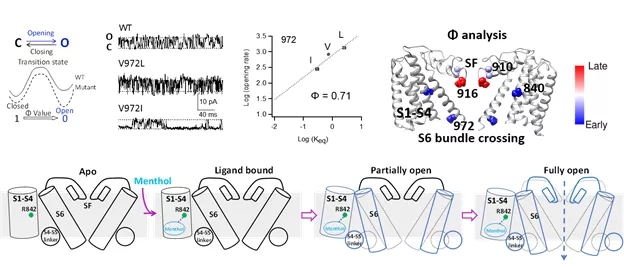
为了阐明薄荷醇打开TRPM8通道时引起的动态构象变化,研究人员在活细胞中将荧光非天然氨基酸ANAP标记在TRPM8通道的各个关键位置,观察到了薄荷醇激活TRPM8过程中的ANAP荧光光谱变化,表明薄荷醇的结合引起了TRPM8通道跨膜区的广泛构象变化。应用薄荷醇引起的ANAP荧光光谱变化的实验数据作为限制条件,该研究使用Rosetta计算生物学平台上构建了TRPM8的开放态模型,为理解薄荷醇激活TRPM8通道的完整结构机制提供了强有力的支撑。

为了进一步阐明薄荷醇引起的动态构象变化的时间顺序,研究人员进行了基于单通道电生理记录的Φ分析,即在特定位点引入数个点突变,通过单通道记录,测量开放事件与关闭事件的时间长度分布,计算微观开放速率和关闭速率,进而通过对自由能的扰动大小的计算,推测该特定位点在离子通道被配体激活的动态过程中,发生构象变化的时间先后顺序。通过Φ分析,研究人员发现薄荷醇首先引起结合口袋周围的构象变化,继而引起S6附近的构象变化,最后导致选择性滤器附近的构象变化。
总之,该研究提出了薄荷醇结合并激活TRPM8通道的机制,推进了我们对化学刺激感受的认识,也为该通道为靶点的药物研发打下坚实的基础。浙江大学基础医学院生物物理学系的博士生徐丽臻同学为该研究的第一作者,该研究的共同通讯作者为浙江大学基础医学院生物物理学系的杨帆研究员和杨巍教授,以及东北林业大学的杨仕隆教授。杨帆研究员得到了国自然面上项目、青年项目、浙江省杰青项目等的资助,该研究也得到了浙江大学医学院公共技术平台在成像与计算上的支撑。
原文链接:https://www.nature.com/articles/s41467-020-17582-x
参考文献
1. Eccles, R., Menthol and related cooling compounds. J Pharm Pharmacol, 1994. 46(8): p. 618-30.
2. McKemy, D.D., W.M. Neuhausser, and D. Julius, Identification of a cold receptor reveals a general role for TRP channels in thermosensation. Nature, 2002. 416(6876): p. 52-8.
3. Peier, A.M., A. Moqrich, A.C. Hergarden, A.J. Reeve, D.A. Andersson, G.M. Story, T.J. Earley, I. Dragoni, P. McIntyre, S. Bevan, and A. Patapoutian, A TRP channel that senses cold stimuli and menthol. Cell, 2002. 108(5): p. 705-15.
4. Diver, M.M., Y. Cheng, and D. Julius, Structural insights into TRPM8 inhibition and desensitization. Science, 2019.
5. Yin, Y., S.C. Le, A.L. Hsu, M.J. Borgnia, H. Yang, and S.Y. Lee, Structural basis of cooling agent and lipid sensing by the cold-activated TRPM8 channel. Science, 2019.
6. Yin, Y., M. Wu, L. Zubcevic, W.F. Borschel, G.C. Lander, and S.Y. Lee, Structure of the cold- and menthol-sensing ion channel TRPM8. Science, 2018. 359(6372): p. 237-241.