改变烹调方法,适当控制饮食,增强机体运动……大多数人都相信“管住嘴,迈开腿”是健康减重的不二法则,可是也常常有人说,“怎么办,我喝水也长肉!”
更让人疑惑的是,我们也发现身边很多患有高血压、糖尿病、脂肪肝的人,看起来似乎并不胖,随着科学研究的深入,人们越来越多地认为这些病症出现可能与人体脂肪代谢和免疫调节有关联。
最近多项研究表明,胆汁酸及其衍生物对原发性硬化性胆管炎、非酒精性脂肪性肝炎、II型糖尿病和肌萎缩性(脊髓)侧索硬化症等疾病有治疗作用。胆汁酸是由肝细胞产生,并由胆管分泌到肠道的两亲性代谢产物,在消化过程中对人体摄入的脂肪有重要的乳化作用。肝脏生成的两种初级胆酸可由肠道菌群进一步代谢为多种次级胆酸,对代谢和炎症相关的生理过程有重要的调节作用。作为脂肪代谢和免疫调节的重要参与者,胆汁酸及其受体为核心构成的肝脏-胆汁酸-肠道菌群信号转导轴,成为近期生物医学研究的热点之一。
而胆汁酸如何更好地发挥作用,关键在于要揭开GPBAR这一蛋白的神秘面纱,近日,浙江大学基础医学院、良渚实验室(系统医学与精准诊治浙江省实验室)张岩研究员团队、中科院上海药物研究所谢欣研究员团队以及山东大学基础医学院的于晓教授和孙金鹏教授团队在Nature上发表研究论文“Structural basis of GPBAR activation and bile acid recognition”,揭示其独特机制。

在这项新的研究中,科学家们首次利用单颗粒冷冻电镜重构技术解析了胆汁酸受体GPBAR在合成配体P395以及胆汁酸类似物INT-777作用下与Gs蛋白三聚体形成的复合物的高分辨率结构(图1),阐明了GPBAR非经典激活机制以及受体第三个胞内环在受体激活中的重要功能;明确了GPBAR对两亲性配体的识别机制;揭示了GPBAR识别多种胆汁酸的指纹图谱;鉴定了天然胆汁酸结合受体的别构位点;同时还探究了不同配体介导受体下游信号偏向性的结构基础。因此本研究对肝肠轴的信号转导机制研究,以及GPCR的激活过程等都将有广泛的影响。
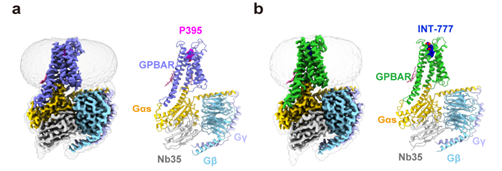
图1:P395和INT-777激活的GPBAR-Gs复合物结构(分辨率为3.0Å)
★在看最新研究之前,我们有必要回顾下之前有关不同类型GPCR的激活机制及其药理学研究意义。
G蛋白偶联受体(GPCR)是一类具有七次跨膜螺旋的膜受体蛋白,几乎参与了所有生理和病理过程。作为重要的药物靶点,目前近40%的药物通过GPCR发挥药效。根据序列以及结构的差异性,GPCR可以分成5大类:A类视紫红质受体(rhodopsin),B1类分泌素受体(secretin),B2类粘附受体(adhesion),C类谷氨酸盐受体(glutamate),以及F类卷曲受体(Frizzled)。探究不同类型GPCR的激活机制对于理解GPCR家族的信号转导机制以及推动靶向GPCR的药理学研究至关重要。
2011年,Brian Kobilka教授团队突破性地利用X射线晶体衍射技术解析了肾上腺素受体β2AR与G蛋白复合物的结构,首次展示了A类GPCR受体的激活构象以及激活机制(Nature 2011;目前唯一的GPCR与天然G蛋白复合物的晶体结构)。2017年,Georgios Skiniotis和Patrick Sexton教授团队突破性地利用单颗粒冷冻电镜技术解析了两个GPCR与G蛋白复合物的激活结构,首次揭示了B1类受体的激活构象(Nature 2017;Nature 2017;张岩研究员为这两项工作的第一或共同第一作者);随后多种B1类受体与A类受体与效应蛋白的复合物结构通过冷冻电镜技术获得解析。2019年,张岩研究员团队与徐华强研究员团队、王明伟研究员团队以及Jean-Pierre Vilardaga团队首次展示了B1类GPCR与配体动态作用过程(Science 2019);随后揭示了胆固醇在B1类GPCR激活过程中的重要作用(Molecular Cell 2020)。2019年,李晓淳和张诚教授团队利用冷冻电镜技术首次展示了F类平滑受体SMO与Gi复合物的激活构象(Nature 2019)。2020年,张岩研究员团队和刘剑锋教授团队利用单颗粒冷冻电镜技术首次报道了C类GPCR代表性受体GABAB受体的高分辨激活态结构以及不同G蛋白偶联状态复合物结构,首次揭示了C类异源二聚GPCR的激活机制及其与G蛋白偶联的独特模式(Cell Research 2020)。
在生物体内,胆汁酸主要通过激活膜受体(GPBAR/TGR5,缺少NPxxY等保守motif的A类GPCR)和核受体FXR发挥作用。GPBAR是G蛋白偶联受体(GPCR),胆汁酸的许多有益作用可归因于GPBAR与Gs信号途径,如降血糖作用,促白色脂肪细胞组织褐化,对抗脂肪变性等。最新研究也表明,胆汁酸可激活GPBAR与arrestin的相互作用,并介导抗病毒的天然免疫反应。然而,GPBAR激活导致的胆囊肥大及皮肤搔痒等副作用也影响了靶向该受体的新药研发。因此,从分子层面解析GPBAR如何识别不同胆汁酸并偏向性激活下游通路的机制,对GPBAR生理功能的理解及靶向该受体的新药研发具有重大意义。
(1)本研究明确提出了GPBAR不同于经典的受体激活机制与分子开关。此前“toggle switch”的结合和PIF基序的结构重排都被认为是大多数GPCR的共同机制。而对GPBAR而言,它的第六个跨膜螺旋(TM6)中虽然具有“toggle switch” W237氨基酸,但并不具备分子开关的功能;发挥分子开关功能的残基却是其上一个螺旋中的Y240。有趣的是,GPBAR的TM6与TM3的相互距离在所有已有结构报道的GPCR中最大,整个激活模式与结构重排都是一种全新的方式(图2)。这些新的发现扩展了人们对GPCR激活机制的认识。
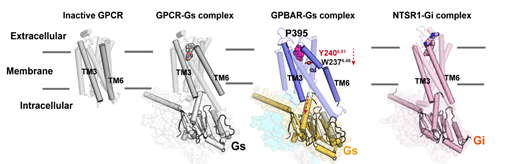
图2:GPBAR独特的激活机制
(2)GPCR的第三个内环的功能大家一直不甚清楚。本研究观察到了受体完整清晰的第三个内环密度。首次发现了GPBAR受体的第三个胞内环(ICL3)可以和Gs蛋白特异性结合。并通过序列比对及生化实验发现,GPCR的ICL3与Gs的结合存在一类通用的规律,即这类GPCR受体可以通过ICL3偶联基序(R/KψXR/KXψXR)与Gs结合。这些研究阐明了此前尚未了解的GPCR-G蛋白的偶联的新机制。
(3)本研究首次揭示两亲性代谢产物是如何被GPBAR识别并发挥作用的。GPBAR的配体结合口袋中由第五个螺旋及两个胞外环来构成疏水侧面,从而面对胆汁酸的疏水一面,而胆汁酸的另一个亲水结合面则朝向螺旋6和7之间的亲水氨基酸集团,形成特异性的相互作用。
(4)阐明了胆汁酸受体对多种不同胆汁酸识别的指纹图谱(图3)。研究通过对内源性胆汁酸类似物INT-777与GPBAR的结合模式的分析,以及内源性配体CA、DCA、DCA、LCA、TCA、GCA、TDCA、UDCA和TUDCA的配体结合,生化及药理学分析,找到了GPBAR识别不同胆汁酸的指纹图谱。这为深入理解胆汁酸的作用机理以及针对于GPBAR的药物设计提供了理论基础。

图3:受体识别内源性胆汁酸的结构指纹图谱
(5)发现了胆汁酸在受体上的别构调控位点(图4a)。团队成员通过电镜结构和分子动力学模拟解析,发现GPBAR受体TM3-5附近存在配体第二个结合口袋。通过对内源性配体的结构及生化数据分析,发现10种胆汁酸中的5个具有12-OH的胆汁酸可以结合在该位点上,并别构调控胆汁酸受体激活的过程(图4b)。这为理解胆汁酸如何作用于其膜受体的生理过程,以及发展和开发别构位点的小分子药物提供理论基础。
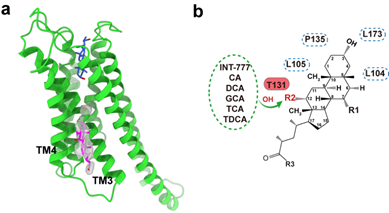
图4:GPBAR受体上的别构调控口袋。
(6)最近的研究刚刚发现胆汁酸受体可以通过Arrestin偏好性途径调控不同的生理功能。偏向性配体的研究及开发是目前GPCR领域的一个热点,本研究应用的两个化合物具有不同的偏向性。通过对结构及生化数据的分析,发现GPBAR的ECL1,ECL3及ICL1是决定配体偏向性的结构基础(图5),这为开发偏向性配体及药物的开发提供理论基础。
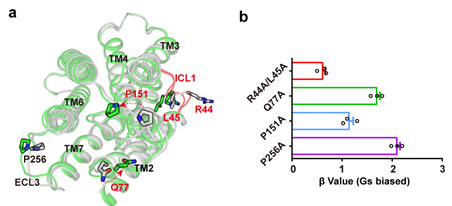
图5:GPBAR配体偏向性调控的结构基础。
综上,本研究不仅揭示了GPBAR参与胆汁酸识别和其别构效应的独特结构特征,而且阐明了GPCR超家族中配体结合口袋与G蛋白结合位点之间存在着新的激活及相互作用机制。考虑到GPBAR在代谢和免疫调节中的重要作用,GPBAR与激动剂的高分辨率结构以及这些新的发现将促进基于结构的药物设计。
据悉,浙江大学基础医学院博士后毛春友、明倩倩,山东大学基础医学院博士后杨帆、副教授肖鹏及博士生郭璐璐、林婧宇、吴襄为共同第一作者;浙江大学基础医学院博士后沈庆亚、研究助理沈丹丹、浙江大学医学院蛋白质平台马骋博士参与本研究工作;张岩研究员,于晓教授、谢欣研究员和孙金鹏教授为本论文共同通讯作者。
张岩研究员获得国家科技部重点研发计划青年项目、国家自然科学基金委优秀青年科学基金、浙江省自然科学基金委杰出青年科学基金等项目的大力支持。冷冻电镜数据收集在浙江大学冷冻电镜中心完成。