5月13日,浙江大学基础医学院刘祥瑞/周天华课题组在Acta Pharmaceutica Sinica B杂志在线发表了题为“Macrophage-evading and tumor-specific apoptosis inducing nanoparticles for targeted cancer therapy” 的研究论文。研究者利用表达肿瘤特异性杀伤蛋白的肝成纤维细胞膜包覆策略,开发出既能有效地降低单核吞噬细胞系统(MPS)截留,又可特异性杀伤肝和结直肠肿瘤细胞的“细胞+分子双靶向”仿生纳米系统,以应对纳米药物在癌症治疗方面的挑战。
已上市的抗肿瘤纳米药物显著降低了小分子化疗药物的毒副作用,但治疗效果并不具备明显优势,主要原因之一是纳米药物在肿瘤组织富集能力不足,其中单核吞噬细胞系统(MPS)对纳米药物的截留是影响纳米药物在靶组织蓄积的重要因素。聚乳酸-聚乙醇酸(PLGA)是已获批的注射用药用辅料,因具有良好的生物相容性和可降解性被广泛用于医用材料领域。
本研究使用PLGA纳米颗粒(NP)为模型,采用激活态肝成纤维细胞膜包被的方法,得到包覆成纤维细胞膜的纳米颗粒(Cell membrane coated nanoparticle,M-NP)。通过肝成纤维细胞表面CD47的吞噬躲避作用以及减少NP表面蛋白冠的形成作用,降低巨噬细胞对NP的内吞。同时,借助肿瘤细胞膜与激活态成纤维细胞膜的黏附作用,可以增加肿瘤细胞对NP的摄取。
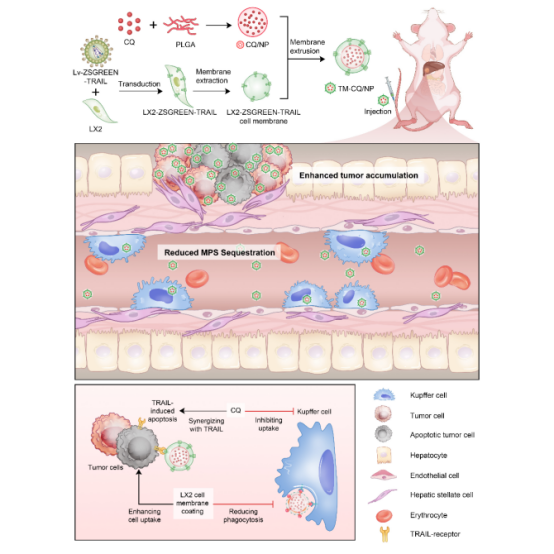
研究团队构建了稳定表达肿瘤坏死因子相关凋亡诱导配体(Tumor necrosis factor-related apoptosis-inducing ligand,TRAIL)的肝成纤维细胞系(LX2),从而得到表达TRAIL蛋白的LX2细胞膜(TRAIL-expressing cell membrane,TM)。包覆TM的纳米颗粒(TM-NP)可以通过TRAIL蛋白及其死亡受体的结合特异性诱导肿瘤细胞凋亡,而对正常细胞影响较小。将临床自噬抑制剂氯喹(Chloroquine,CQ)包载在TM-NP内核,制备得到TM包覆的CQ/NP纳米颗粒(TM-CQ/NP)。CQ的引入可以进一步抑制巨噬细胞对M-NP的摄取,并与TRAIL蛋白协同诱导肿瘤细胞凋亡。

在原位肝癌及结直肠癌腹膜转移小鼠肿瘤模型中,验证了TM-CQ/NP具有躲避巨噬细胞内吞,增加肿瘤组织中的蓄集的作用,并获得优异的抗肿瘤效果。该研究首次报道激活态成纤维细胞膜包覆纳米颗粒的优势,并巧妙结合治疗蛋白膜稳定表达技术以及小分子药物纳米内核装载技术,为仿生纳米颗粒的设计提供了新的范式。

浙江大学基础医学院/浙江大学医学院附属第二医院刘祥瑞副教授为本论文的通讯作者,博士生刘子墨与浙江大学医学院附属第四医院特聘副研究员周雪飞为论文的共同第一作者。医学院周天华教授以及化工学院申有青教授为本研究提供了有力支持。研究受国家自然科学基金资助,已申请发明专利“一种工程化细胞膜纳米颗粒及其制备方法和应用”(202210347663.5)。