真核生物的mRNAs以及包括tRNAs,rRNAs在内的非编码RNA中存在多种RNA修饰,近年来研究发现RNA修饰在遗传信息传递过程中发挥重要作用,这些发现也引出了表观转录组学概念。
N6, 2’-O-二甲基腺苷(m6Am)是脊椎生物mRNAs上一种含量丰富的RNA甲基化修饰,存在于mRNA的转录起始区域。通常,mRNA的5’末端携带7-甲基鸟苷(m7G)帽子结构,m7G后的第一个2’-O-甲基腺苷(Am)会被催化为m6Am。在m6Am修饰被发现的四十多年后,2018年底,Tsutomu Suzuki 课题组在Science杂志,北京大学伊成器课题组在Cell Research杂志,几乎同时报道发现磷酸化CTD相互作用因子1(PCIF1)是第一个也是目前唯一一个mRNA的m6Am修饰酶,特异性识别mRNA上的5’帽子结构,发挥m6Am甲基转移酶活性。目前,PCIF1介导的m6Am修饰在基因表达调控中的具体功能尚未有定论,更重要的一个科学问题,PCIF1介导的m6Am修饰在肿瘤发生发展中的生物学功能是什么?也完全未知。
2022年5月21日,浙江大学基础医学院周天华/卓巍教授课题组与北京大学伊成器教授课题组合作,在Cell Discovery杂志上发表了题为“m6Am Methyltransferase PCIF1 is Essential for Aggressiveness of Gastric Cancer Cells by Inhibiting TM9SF1 mRNA Translation”的研究论文。首次揭示了PCIF1及m6Am修饰在调控胃癌细胞生长和转移中的关键作用,并佐证了PCIF1给特定基因mRNA带上的m6Am修饰,能抑制靶基因mRNA翻译,降低基因表达。
周天华/卓巍教授课题组长期致力于胃肠肿瘤发生发展的调控机制研究,通过与伊成器教授课题组合作,发现临床胃癌患者肿瘤组织中PCIF1表达水平以及mRNAs中的m6Am修饰均异常上调,并且PCIF1的高表达与胃癌进展以及患者不良预后均显著相关。
后续实验发现,PCIF1介导的m6Am修饰对于维持胃癌细胞的增殖和转移恶性表型至关重要。质谱技术确证了敲低PCIF1确实显著降低了胃癌细胞中mRNA整体的m6Am修饰水平,能明显抑制胃癌细胞的增殖能力和迁移侵袭能力。课题组通过引入m6Am酶活突变的PCIF1,体内外实验验证了PCIF1对胃癌细胞恶性生物学能力的调控作用依赖于其m6Am修饰酶活性。
在探索下游机制过程中,课题组通过m6Am测序技术、RIP技术并联合胃癌数据库分析等,筛选并鉴定了TM9SF1 mRNA可能是PCIF1调控胃癌进展的重要下游靶基因。通过mRNA转录、mRNA稳定性实验和多聚核糖体谱检测的mRNA翻译等实验,课题组确证了PCIF1介导的m6Am修饰不影响靶基因TM9SF1 mRNA的转录水平和稳定性,而是通过抑制TM9SF1的mRNA翻译效率降低其蛋白表达水平,这种mRNA翻译抑制的作用并不会显著影响细胞整体的翻译机器。通过体外合成m6Am修饰的mRNA,导入细胞也验证了m6Am修饰能抑制mRNA的翻译。
通过临床分析、体外细胞实验和体内动物实验,结合体内外挽救实验,下游靶基因TM9SF1也在本项研究中第一次被鉴定为可能是胃癌新的抑癌基因。TM9SF1能强烈抑制胃癌细胞的增殖和转移能力,TM9SF1的缺失会显著促进胃癌细胞的恶性表型。我们的研究提示胃癌细胞中修饰酶PCIF1的高表达通过增加特定靶基因如TM9SF1 mRNA的m6Am修饰水平,抑制TM9SF1 mRNA的翻译,降低TM9SF1的蛋白表达,进而维持胃癌细胞的生长和转移能力。
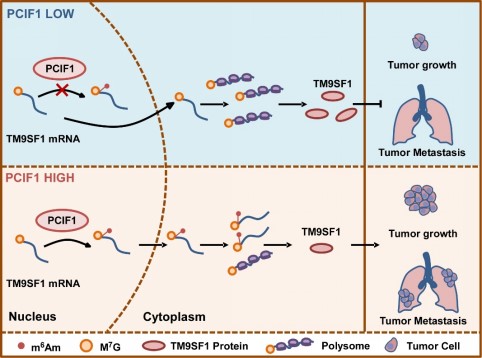
本研究以胃癌为模型,首次揭示了修饰酶PCIF1及其介导的mRNA的m6Am修饰在肿瘤进展转移中的重要生物学功能;通过具体的靶基因研究,佐证了m6Am修饰在遗传信息转递过程中可能发挥抑制靶基因mRNA翻译的作用。本研究探明的PCIF1/m6Am/TM9SF1通路在维持胃癌细胞生长和转移中发挥重要作用。
浙江大学基础医学院周天华、卓巍教授和北京大学生命科学学院伊成器教授为该论文的共同通讯作者,浙江大学基础医学院卓巍教授,孙萌博士,张露博士和北京大学生命科学学院王坤博士为本论文的共同第一作者。本研究受国家自然科学基金、浙江省自然科学基金、中央高校基本科研专项资金的资助。