环状RNA(circRNA)作为表观遗传调控分子参与了肿瘤发生、恶性进展、免疫逃逸和耐药等多种生物学过程。转录组测序数据显示存在一类circRNA在肿瘤患者外周血中水平明显升高,而在肿瘤组织样本中表达却明显降低。 然而这种差异表达模式的机制和生物学意义仍不清楚。
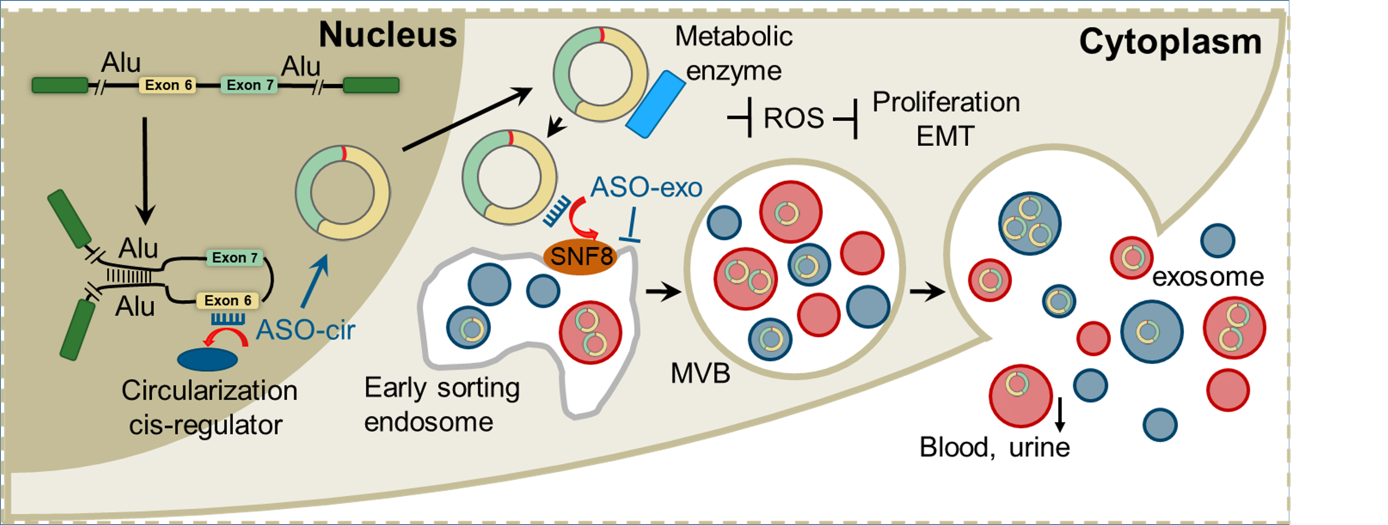
2022年2月11日,浙江大学基础医学院病理学与病理生理学系张红河/来茂德教授课题组在Molecular Cancer杂志上在线发表了题为“Tumor-suppressive circRHOBTB3 is excreted out of cells via exosome to sustain colorectal cancer cell fitness”的研究论文。该研究不仅阐明了circRHOBTB3在结直肠癌中发挥抑癌作用的分子机制,而且提出肿瘤细胞能够主动通过外泌体将具有抑癌作用的cirRNA分泌出胞外维持癌性的理论。此外,该研究还鉴定了circRHOBTB3环化和外泌体特异性分选的功能原件,采用ASO靶向环化和外泌体分泌调节元件增加肿瘤细胞内circRHOBTB3水平,达到抑制结直肠癌恶性进展的治疗效应,为结直肠癌治疗提供了一个新的干预策略。
该研究对公共数据库中多种类型癌症患者的血浆外泌体中的circRNA水平进行了全面分析,结合临床队列的血清及组织样本,发现circRHOBTB3在外周血中水平明显升高,而在肿瘤组织样本中表达却明显下降。进而通过体内外实验证明circRHOBTB3主要通过抑制代谢降低细胞内ROS水平从而抑制肿瘤细胞的进展和转移。进一步发现ESCRT-II复合物的关键组分SNF8通过结合circRHOBTB3上特定的序列参与将circRHOBTB3分拣到外泌体中,通过外泌体将细胞内的circRHOBTB3排出以降低胞内circRHOBTB3水平。有趣的是发挥促癌作用的环状RNA并没有被分选至外泌体排出胞外,而是被保留在肿瘤细胞内。此外我们还鉴定了调控circRHOBTB3环化的关键元件,并针对环化和外泌体分选的功能元件设计并合成了ASO,以增加circRHOBTB3的环化并阻断circRHOBTB3外泌体的分泌;体外和体内试验证实了这些ASO能够增加结直肠癌细胞内circRHOBTB3水平抑制肿瘤细胞生长和转移。
综上,circRHOBTB3在结直肠癌中发挥作用,肿瘤细胞必须通过外泌体将其排出胞外以维持其癌性。通过针对环化和外泌体分泌提高肿瘤细胞内具有抑癌作用的circRHOBTB3水平的ASO可能会成为一种新的抗肿瘤策略。
浙江大学基础医学院张红河教授和来茂德教授为论文的共同通讯作者,浙江大学基础医学院博士生陈超一、俞鸿飞和博士后韩丰艳为论文的共同第一作者。项目受到国家自然科学基金和中国医学科学院医学与健康科技创新工程项目资助。