G蛋白偶联受体(GPCR)是人体内最大的膜受体蛋白家族,其在细胞信号传导中发挥重要功能,同时也与人体疾病密切相关,是40%以上的上市药物的作用靶点【1】。根据结构和序列的差异性,人体中GPCR可分为A、B、C和F四种类型。近年来的结构功能研究分别揭示了A、B1、B2和F类以单体形式发挥功能的GPCP的激活机制【2-5】。研究显示单体GPCR偶联G蛋白采用相似的模式,即受体的激活使跨膜结构域TM6的外移,进而形成较大的口袋用于结合Gα亚基的C末端,从而激活G蛋白下游信号通路。然而长期以来,以二聚化形式发挥功能的C型GPCR偶联G蛋白的分子机制一直未能揭示,严重阻碍了人们对C型受体信号转导机制的理解。
2021年4月28日,华中科技大学生命科学与技术学院刘剑峰教授团队与浙江大学基础医学院、良渚实验室张岩研究员团队在Nature杂志在线发表了题为“Structural basis of GABAB receptor-Gi protein coupling”的研究论文。本研究突破性地鉴定了C型异源二聚体GABAB受体与G蛋白复合物的高分辨率冷冻电镜结构,在世界上首次揭示二聚体GPCR偶联G蛋白的新模式。
C型GPCR主要包括代谢型γ-氨基丁酸受体(GABAB)、代谢型谷氨酸受体(mGlu)、钙敏感受体(CaSR)和味觉受体1(Taste 1)等【6】。C型受体与众多神经和精神疾病相关,包括癫痫、疼痛、焦虑、抑郁、精神分裂症、药物成瘾、Rett综合征和癫痫性脑病等。GABAB受体是第一个被发现和证明的GPCR异源二聚体,是C型二聚体GPCR的典型代表【7,8】。GABAB受体广泛表达在中枢神经系统中,参与学习、记忆和突触信号传递等重要的生理进程【9】。GABAB受体由GB1和GB2两个亚基组成,每个亚基分别由胞外结构域(VFT),七次跨膜域(TMD)和胞内域构成【10】。GABAB受体激活采取典型的非对称性调节机制,即GB1的VFT负责配体识别,而GB2的TM偶联Gi/o蛋白调控下游信号。刘剑峰/张岩合作团队在2020年国际首次鉴定全长GABAB受体非激活态与激活态的精细三维空间结构(详见BioArt报道:张岩/刘剑峰合作解析代谢型γ-氨基丁酸受体激活机制的结构基础),阐明了GABAB受体激活时的构象转变过程,鉴定了正向变构调节剂的结合口袋,极大地促进了GABAB受体的激活机制研究和靶向药物开发。同时,该工作还首次解析了低分辨的GABAB-Gi复合物结构,发现由于潜在的空间位阻,二聚化的GABAB受体仅能偶联一个G蛋白【11】。然而其非对称激活和偶联G蛋白的信号转导的分子机制还未被揭示。
本研究团队在前期工作的基础上再次进行课题攻关,先后突破复合物组装、均一冷冻样品制备、动态构象数据处理等挑战,最终完成高分辨GABAB受体-Gi蛋白复合物的电镜结构鉴定(图1a)。结构分析发现与单体GPCR不同,GABAB受体偶联G蛋白时,两个亚基跨膜域的TM6均没有发生外移,但是GB2亚基的TM3和TM5却发现较小幅度的外扩,使三个胞内环形成一个较浅的口袋结合G蛋白。与单体GPCR相比,G蛋白α5螺旋插入GABAB受体的深度低了~10Å,并且主要与胞内环互作。这些结果结合以前的其他C型GPCR功能研究,推测C型GPCR二聚体都采用了这种不同于A、B1、B2和F类GPCP的激活的独特的G蛋白偶联模式(图1b-d)。
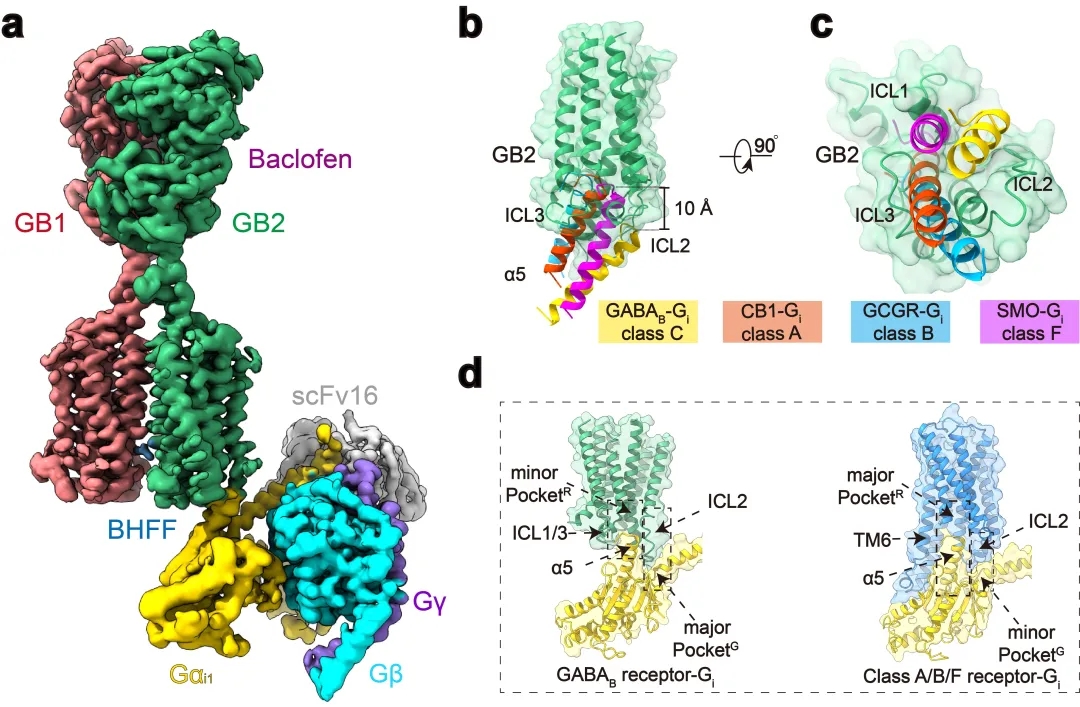
图1:GABAB偶联G蛋白复合物的新颖结构
此外,研究发现了GABAB偶联G蛋白后的精细构象变化,包括GB1和GB2之间的旋转,以及GB2亚基TM的细节变化。通过结构分析,研究人员发现结合激动剂的GABAB受体偶联G蛋白后,其GB2-TM相较于GB1-TM产生进一步的逆时针旋转,使得GB1和GB2的跨膜域界面进一步靠近,稳定激活状态。研究人员专注于GB2-TM的内部精细的构象变化,分析发现GB2 TM3/TM5胞内端的构象变化是起始于TM3上F586侧链苯环的大角度旋转。信号转导实验分析发现,将F586突变成小侧链丙氨酸后,受体偶联G蛋白的能力显著下降。此外,在GB2-TM的底部,多个带电荷的氨基酸形成的盐桥进一步稳定了受体的激活态,从而揭示了GB2亚基结合G蛋白的结构基础(图2)。GB2亚基这些独特的构象的变化,最终决定了GABAB偶联G蛋白的非对称性激活模式。
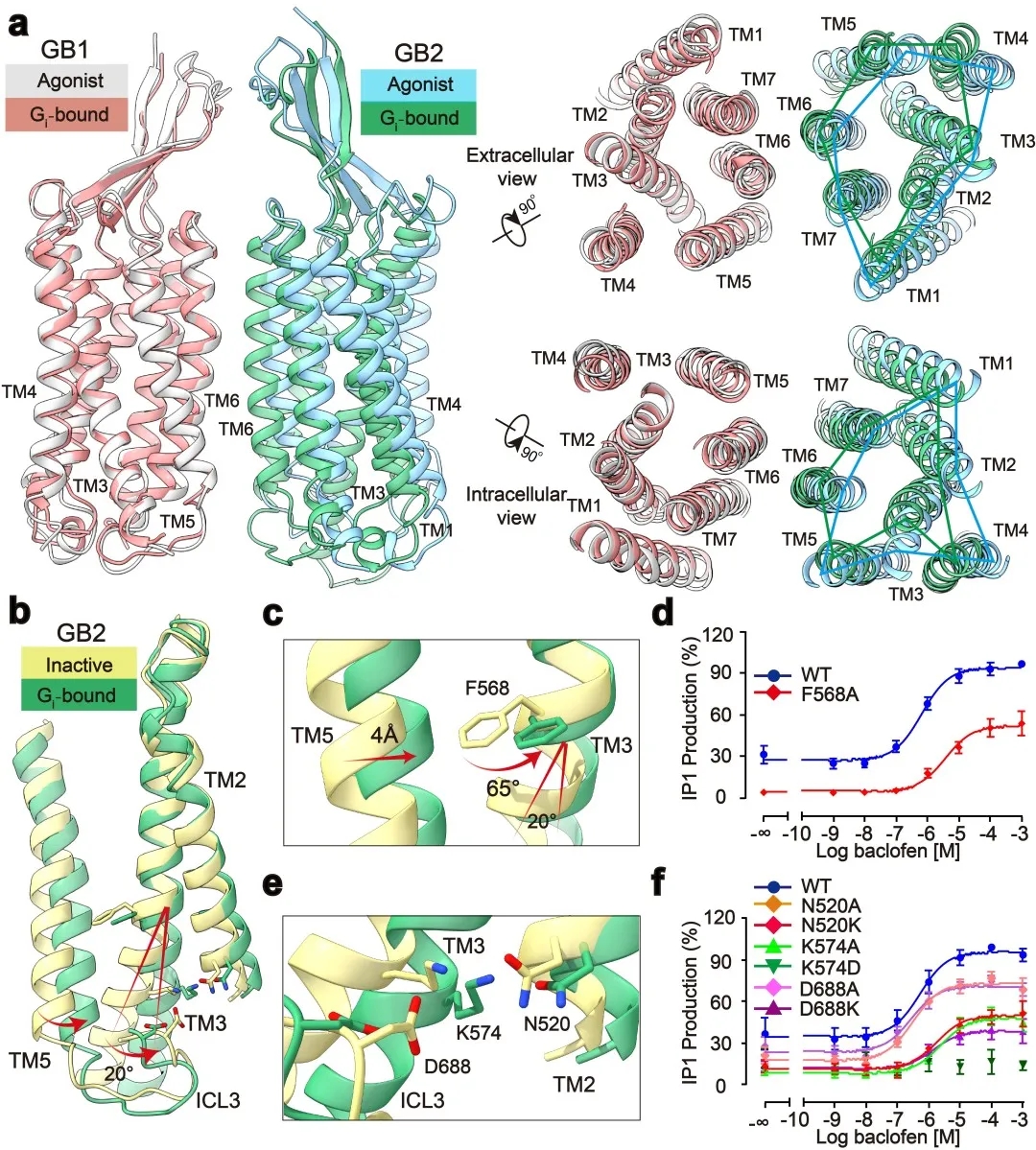
图2:GABAB受体采取非对称性变化的激活机制
GABAB主要通过3个胞内环偶联Gi蛋白:其中较长的ICL2主要与G蛋白上α5,αN,β2-β3的结合,占据了约80%的互作界面;而较短的ICL1、ICL3主要与G蛋白的α5末端几个氨基酸相互作用,稳定了G蛋白的结合(图3a,b)。此外研究发现GABAB受体选择性识别Gi/o亚型G蛋白是由于Gi/o的H5.23位点是小侧链的半胱氨酸,而Gs、Gq等类型G蛋白的相应位置大侧链的酪氨酸与GABAB受体具有潜在的空间位阻(图3c)。功能实验分析发现,当把H5.23位点的半胱氨酸突变成大侧链的色氨酸后,其偶联G蛋白的能力显著降低,而当突变成小侧链的丙氨酸后,其结合G蛋白的能力没有变化(图3d,e)。

图3:GABAB受体选择性偶联Gi蛋白的分子机制
该项工作完整地阐述了C型异源二聚体GABAB受体的非对称激活机制:在非激活状态下,GABAB受体两个亚基的VFT区都处于开放状态,TM区采用TM3-TM5/TM3-TM5互作界面;激动剂结合GB1-VFT正位口袋后,诱导GB1-VFT闭合,从而使得GB2-VFT旋转,进一步由颈区传导至TM结构域的重排,形成新的TM6/TM6作用界面;PAM以及G蛋白的结合,进一步诱导了GB2的TM区的旋转,形成更稳定的TM6/TM6互作界面;此外GB2亚基F568等残基精细的构象变化,导致其TM3/TM5的胞内端外移,三个胞内环形成较浅的口袋选择性偶联Gi/o蛋白,最终激活下游信号通路(图4)。
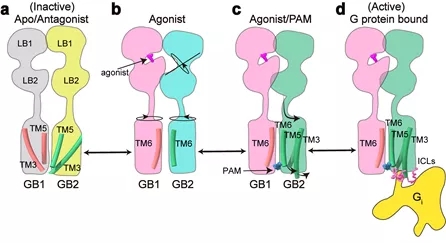
图4:GABAB受体激活的信号转导模型
本研究是浙江大学—华中科技大学细胞信号转导联合实验室在C型GPCR信号转导机制研究中的又一重大突破。该工作也进一步验证了刘剑峰课题组之前发现的C型GPCR二聚体,如代谢型谷氨酸受体(Nat Chem Biol.,2015; PNAS., 2011),GABAB受体(Cell Research,2020; Nat Commun.,2019;EMBO J.,2008)和钙敏感受体(PNAS.,2020)中不同亚基的各个功能域变构调节的激活模式。华中科技大学与浙江大学基础医学院联合培养博士生申仓松、浙江大学基础医学院博士后毛春友、华中科技大学教师许婵娟和博士生晋楠为本研究第一作者。华中科技大学生命科学与技术学院刘剑峰教授,浙江大学基础医学院张岩研究员和法国功能基因研究所PIN JP教授为共同通讯作者。浙江大学医学院蛋白质平台、冷冻电镜中心为本次研究的样品制备和数据收集提供了支持。该工作也得到了浙江中医药大学陈忠教授,浙江大学药学院侯廷军教授和法国功能基因研究所Rondard P教授的协助。本工作得到了科技部国家重点研发计划、国家自然科学基金等项目的大力支持。
参考文献
1 Hauser, A. S., Attwood, M. M., Rask-Andersen, M., Schiöth, H. B. & Gloriam, D. E. Trends in GPCR drug discovery: new agents, targets and indications. Nature reviews. Drug discovery 16, 829-842, doi:10.1038/nrd.2017.178 (2017).
2 Rasmussen, S. G. et al. Crystal structure of the β2 adrenergic receptor-Gs protein complex. Nature 477, 549-555, doi:10.1038/nature10361 (2011).
3 Zhang, Y. et al. Cryo-EM structure of the activated GLP-1 receptor in complex with a G protein. Nature 546, 248-253, doi:10.1038/nature22394 (2017).
4 Ping, Y. Q. et al. Structures of the glucocorticoid-bound adhesion receptor GPR97-G(o) complex. Nature 589, 620-626, doi:10.1038/s41586-020-03083-w (2021).
5 Qi, X. et al. Cryo-EM structure of oxysterol-bound human Smoothened coupled to a heterotrimeric G(i). Nature 571, 279-283, doi:10.1038/s41586-019-1286-0 (2019).
6 Pin, J. P. & Bettler, B. Organization and functions of mGlu and GABA(B) receptor complexes. Nature 540, 60-68, doi:10.1038/nature20566 (2016).
7 Kaupmann, K. et al. GABA(B)-receptor subtypes assemble into functional heteromeric complexes. Nature 396, 683-687, doi:10.1038/25360 (1998).
8 White, J. H. et al. Heterodimerization is required for the formation of a functional GABA(B) receptor. Nature 396, 679-682, doi:10.1038/25354 (1998).
9 Vlachou, S. & Markou, A. GABAB receptors in reward processes. Advances in pharmacology (San Diego, Calif.) 58, 315-371, doi:10.1016/s1054-3589(10)58013-x (2010).
10 Bettler, B., Kaupmann, K., Mosbacher, J. & Gassmann, M. Molecular structure and physiological functions of GABA(B) receptors. Physiological reviews 84, 835-867, doi:10.1152/physrev.00036.2003 (2004).
11 Mao, C. et al. Cryo-EM structures of inactive and active GABA(B) receptor. Cell research 30, 564-573, doi:10.1038/s41422-020-0350-5 (2020).