胞外囊泡由于具有低免疫原性、低毒性、高度的生物兼容性、可自由穿越生物屏障、逃逸溶酶体介导的降解和可进行人工修饰等特点,是非常理想的药物输送载体。然而,要将胞外囊泡作为药物输送载体应用于临床仍面临着不少挑战,包括合适的胞外囊泡来源细胞、临床级别胞外囊泡的制备以及胞外囊泡对疾病组织的特异靶向性。红细胞来源的胞外囊泡作为药物输送载体具备许多天然的优势。因为,红细胞来源的胞外囊泡不含核及线粒体DNA,不涉及影响受者基因组的风险;红细胞是人体数量最多的细胞,可较为方便的实现临床级别胞外囊泡的制备;异体输血具有很高的安全性,红细胞来源的胞外囊泡是红细胞的天然成分,因此可打破自体限制,具有高度的生物兼容性。
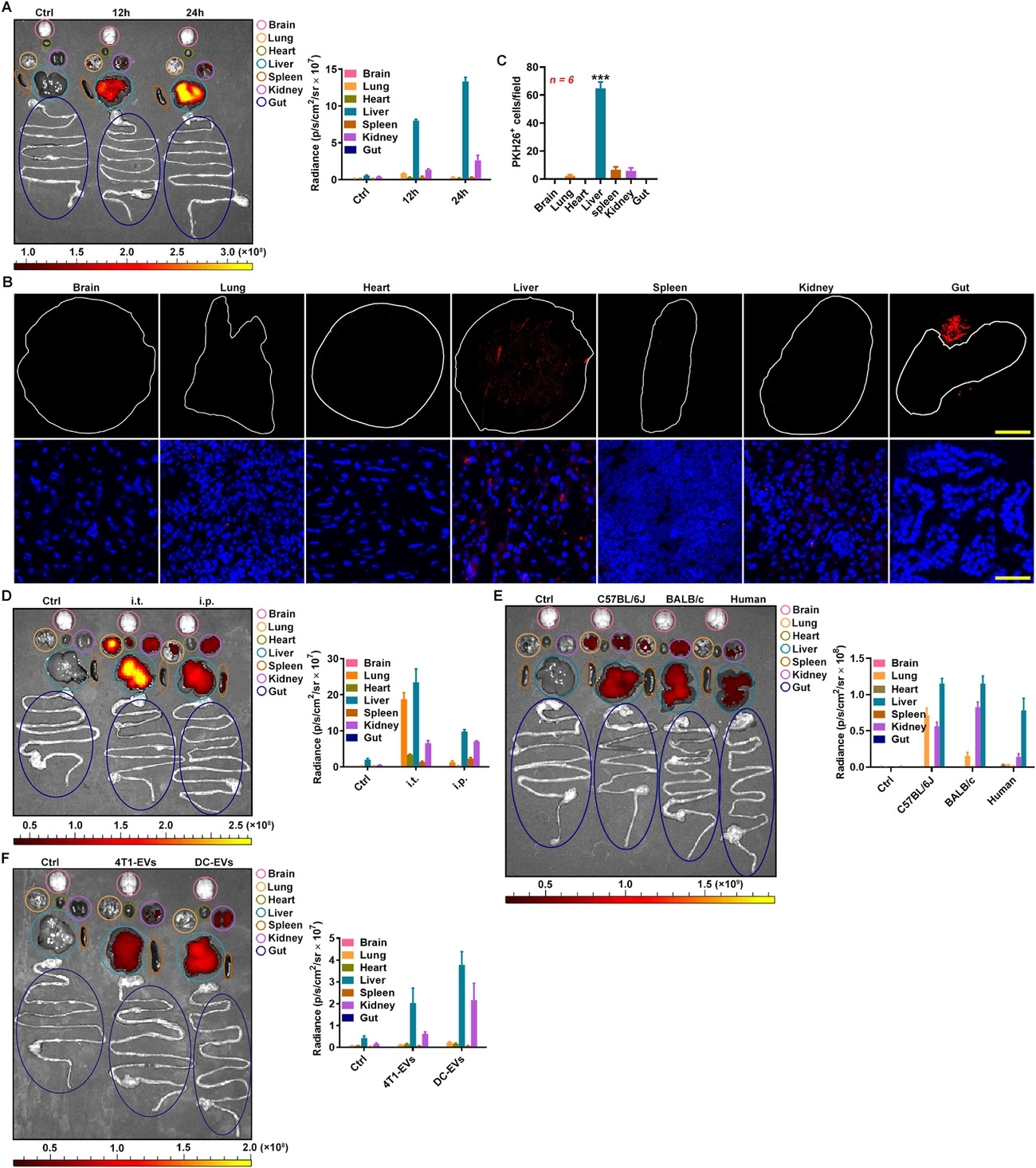
课题组在研究中发现,红细胞来源的胞外囊泡经血输回输后,可自发富集于肝脏。因此,不需要任何的人工修饰,便可实现肝脏的靶向性。通过进一步的研究,课题组发现肝脏富含C1q,通过C1q促进肝巨噬细胞对胞外囊泡的摄取,从而依赖于巨噬细胞实现胞外囊泡的肝脏富集。
基于上述发现,课题组利用电穿孔的方式将miR-155反义寡核苷酸装载至红细胞来源的胞外囊泡,发现该胞外囊泡对小鼠急性肝衰竭具有明显的治疗效果。此外,课题组将阿霉素或索拉非尼装载至红细胞来源的胞外囊泡,发现载药胞外囊泡可明显抑制小鼠原位肝癌的生长。虽然,胞外囊泡所载的药量为传统化疗剂量的1/33,其对肝癌的抑制效果却明显强于传统剂量的化疗药物。更为重要的,载药胞外囊泡具有高度的生物安全性。因此,载药红细胞来源的胞外囊泡可作为治疗肝脏疾病的新型生物制剂,具有很高的临床转化潜力。
该研究成果于2020年12月10日在线发表于国际胞外囊泡协会会刊Journal of Extracellular Vesicles (IF = 14.976)。浙江大学医学院基础医学系蔡志坚教授为本文通讯作者,浙江大学医学院附属第二医院张根生主任医师、黄小芳博士生和修慧清博士生为本文共通第一作者。该研究得到国家基金委、浙江省基金委和中央高校“双一流”经费的支持。
原文链接:https://onlinelibrary.wiley.com/doi/full/10.1002/jev2.12030