阿尔兹海默症(AD)是一种严重的神经退行性疾病,患者通常会出现以记忆力衰退、学习能力减弱为主的症状,并伴有情绪调节障碍以及运动能力丧失,极大地影响个人、家庭乃至社会的发展。目前,全球约有5000万人罹患阿尔兹海默症。预计到2050年,这个数字将增加至1.52 亿。当前,全球每年用于治疗、护理阿尔兹海默症病人的费用已经达到1万亿美元,而这一数字将在2030年达到目前的两倍。阿尔兹海默症的病因复杂,目前主流观点认为,病因是Aβ和Tau淀粉样蛋白沉积造成神经元大量死亡。1998年以来,先后有100多种尝试治疗此病症的药物进入临床实验,但只有6种药物先后获得FDA的批准上市。而令人更加遗憾的是,近年来,世界各大制药公司针对Aβ或Tau蛋白开发的药物均遭到了不同程度的失败。2012年到2020年,先后有多个制药巨头公司,包括,罗氏、礼来、默沙东、强生等宣布治疗阿尔兹海默症的药物开发失败或终止,使得人类对攻克阿尔兹海默症蒙上了一层巨大的阴影。
2020年11月12日,Nature communications 在线发表了浙江大学基础医学院/良渚实验室夏宏光团队的最新研究成果:Pharmacological targeting of MCL-1 promotes mitophagy and improves disease pathologies in an Alzheimer’s disease mouse model。该研究发现,MCL-1蛋白的特异性抑制剂UMI-77可以在模型小鼠中显著缓解阿尔兹海默症的病理特征,促进小鼠认知改善;首次揭示了MCL-1作为线粒体自噬受体蛋白介导线粒体自噬的新机制;提出靶向MCL-1蛋白诱导线粒体自噬是一种有巨大前景的治疗阿尔兹海默症的策略。
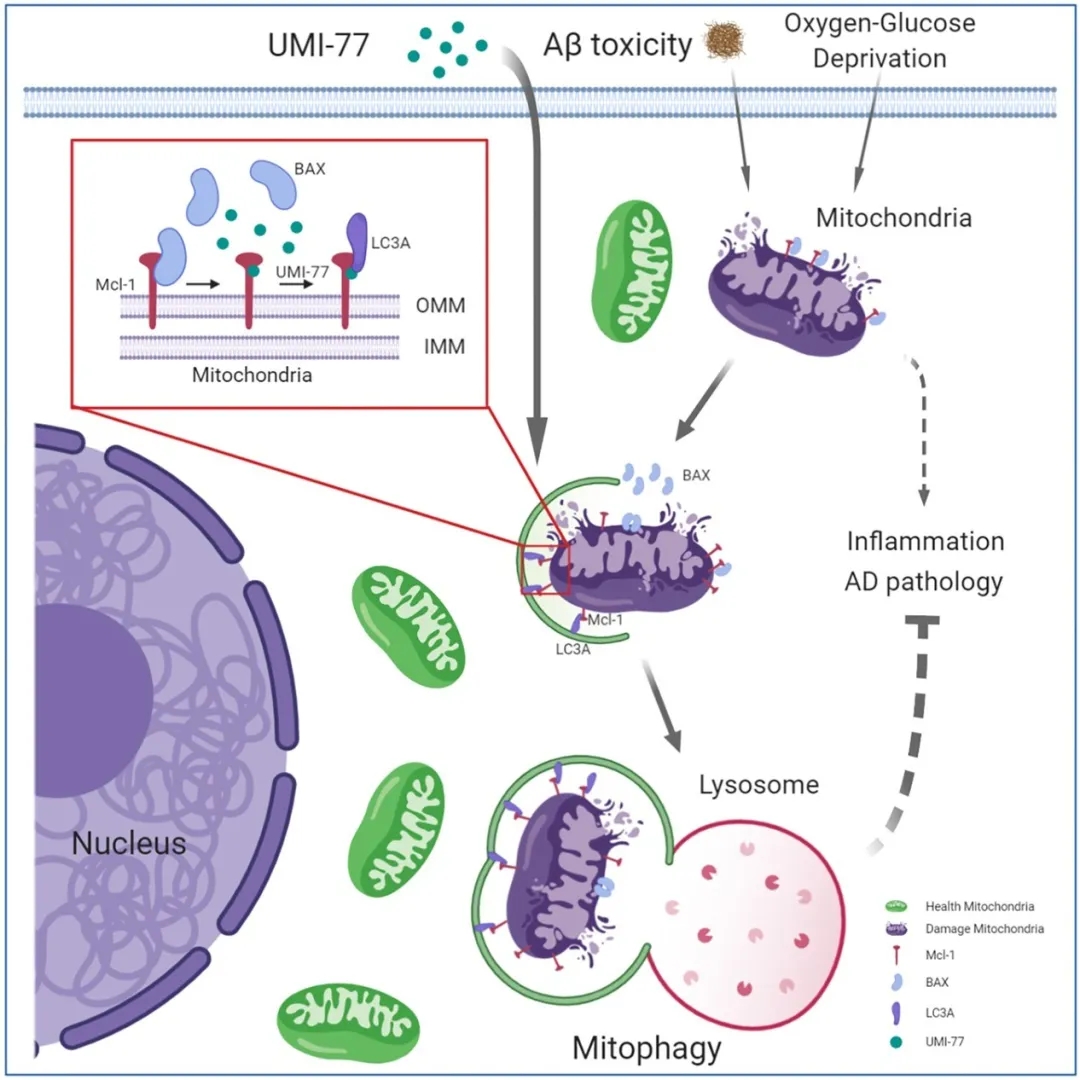
夏宏光团队长期致力于选择性自噬调控人类重大疾病的机制研究和药物开发。前期的研究表明,阿尔兹海默症的病人脑细胞中存在大量的损伤线粒体;进一步文献调研发现,线粒体的功能异常与AD的发生发展密切相关。基于此,他们提出科学假说,恢复线粒体的正常功能是否可以治疗AD?线粒体自噬是细胞中线粒体功能维持和质量控制主要途径之一,于是他们把研究重点放在了诱导线粒体自噬这个点上。
首先,他们通过利用荧光蛋白Keima构建敏感的线粒体自噬定量检测方法,对2000多个FDA批准的药物或候选药物进行了筛选,最终找到了一种可以安全有效诱导线粒体自噬小分子化合物——UMI-77。UMI-77不会造成线粒体损伤,并能选择性地降解破损线粒体。UMI-77不会诱导神经细胞凋亡,甚至在高浓度条件下对凋亡有显著抑制,这可能是由于UMI-77清除了细胞死亡的发生中心——破损线粒体。
通过进一步机制研究,他们发现,UMI-77介导线粒体自噬依赖MCL-1蛋白。过表达MCL-1蛋白可以显著促进线粒体自噬。他们猜测,MCL-1可能是一种新的线粒体自噬受体蛋白。他们鉴定了MCL-1作为线粒体自噬受体蛋白所必须的元件LIR motif和下游的相互作用蛋白LC3A。并且他们通过点突变实验确证,UMI-77介导的线粒体自噬依赖于LIR motif,而不依赖MCL-1的抗凋亡功能。基于此,他们提出了UMI-77的作用模型:UMI-77抑制了MCL-1和Bax的相互作用,释放了游离的MCL-1蛋白,使其和下游LC3A蛋白相互作用,诱导线粒体自噬。
最令人兴奋的是,在隔天给予阿尔兹海默症模型小鼠UMI-77治疗2个月后,小鼠表现出了明显的认知学习能力改善和记忆力的恢复。随后的小鼠生理生化实验也表明,UMI-77可以显著降低小鼠大脑中的炎症因子水平,清除Aβ淀粉样蛋白沉积,并恢复神经元以及神经元线粒体的健康形态。
该研究发现,MCL-1是一种新的线粒体自噬受体蛋白;UMI-77可以通过释放游离的MCL-1蛋白诱导线粒体自噬,并逆转阿尔兹海默症的病理学特征。该研究提示,MCL-1是一个治疗阿尔兹海默症的新药物靶点;诱导线粒体自噬是治疗阿尔兹海默症的有效策略。
浙江大学基础医学院/良渚实验室博士后岑旭峰,徐晓燕,吴荣海,博士生陈艳英及台州学院讲师何福生为该论文的共同第一作者。浙江大学基础医学院/良渚实验室夏宏光研究员为主要通讯作者,哈佛大学Ayaz Najafov博士和台州学院吴劼教授为共同通讯作者。