2020年6月12日,浙江大学基础医学院/附属二院陈伟课题组、浙江大学机械工程学院居冰峰课题组、浙江大学附属一院方维佳课题组以及澳大利亚悉尼大学居理宁课题组合作在单分子力谱技术(生物膜力学探针系统, Biomembrane force probe, BFP)研发方面取得重要进展,在国际权威期刊《Nano Letters》(IF:12.3)杂志上发表 “Ultra-stable biomembrane force probe for accurately determining slow dissociation kinetics of PD-1 blockade antibodies on single living cells”的论文。
作者利用医工交叉的学科优势,在传统的单分子生物膜力学探针系统的基础上成功开发超稳单分子力谱技术,实现在单分子水平上利用活细胞原位动态解析超强的生物大分子互作的动力学特性以及生物力学稳定性。作者利用该新技术准确表征三种临床肿瘤免疫治疗的PD-1抗体与T细胞表面PD-1分子互作特性,发现该新方法所获得的动力学参数与PD-1抗体的肝癌临床治疗有效率吻合,显著优于传统表面等离子共振技术(Surface Plasmon Resonance,SPR)等经典方法所获得的动力学参数。因此,该新方法较传统方法更适合指导免疫治疗抗体的优化、筛选以及临床选择。
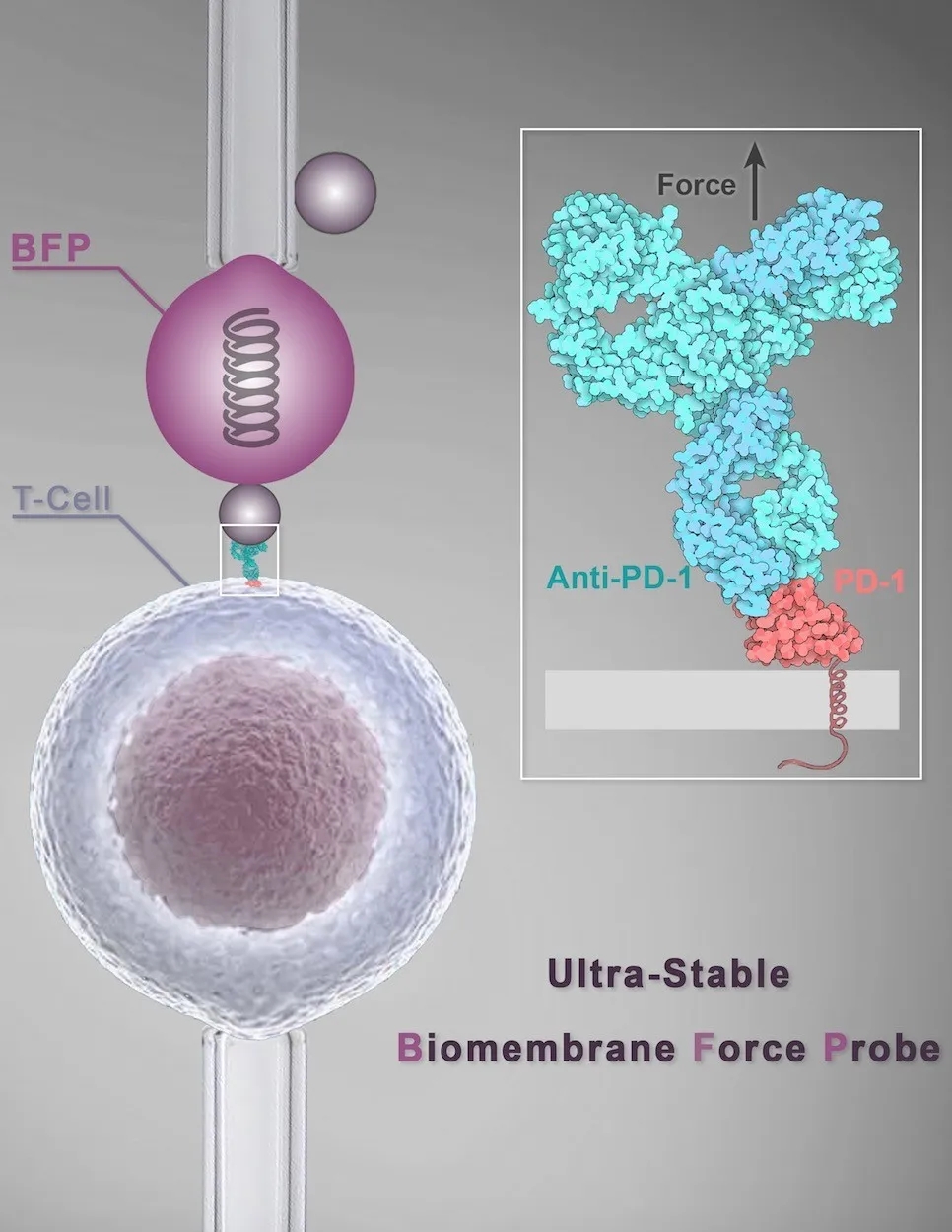
图1. “超稳定”单分子生物膜力学探针系统示意图
(待选封面图,由共同作者:悉尼大学Yunduo Charles Zhao绘制)
PD-1(programmed cell death protein-1)是著名的免疫“刹车”分子,而PD-1分子的免疫治疗抗体依靠其超强亲和力与免疫细胞表面的PD-1分子特异性结合,缓解由PD-1介导的免疫活性抑制。目前,科研领域及制药公司基于常用的SPR技术筛选出的高亲和力PD-1抗体,往往很难与其最终临床治疗有效率直接对应;其主要原因可能是该检测方法脱离了PD-1原位细胞膜环境。另外,免疫治疗PD-1抗体在进入体内后很快被巨噬细胞表面的FcγR受体捕获,其与抗原的相互作用潜在地受到两侧细胞收缩产生的拉力等生物力的作用。因而抗体—抗原相互作用的生物力学稳定性可能成为免疫治疗抗体屏蔽免疫刹车分子效果的决定性因素。利用新研发的“超稳定”单分子生物膜力学探针系统,从单分子水平上原位解析PD-1与其抗体(Nivolumab、Pembrolizumab、Camrelizumab)之间超强互作的解离速率,尤其是生物力调控下的力致解离速率,与其在肝癌免疫治疗中的有效率更为吻合。因此,“超稳定” 单分子生物膜力学探针系统在细胞原位检测抗体药物的亲和力方面具有明显的优势,可以为药物研发提供更具指导意义的亲和力参数。
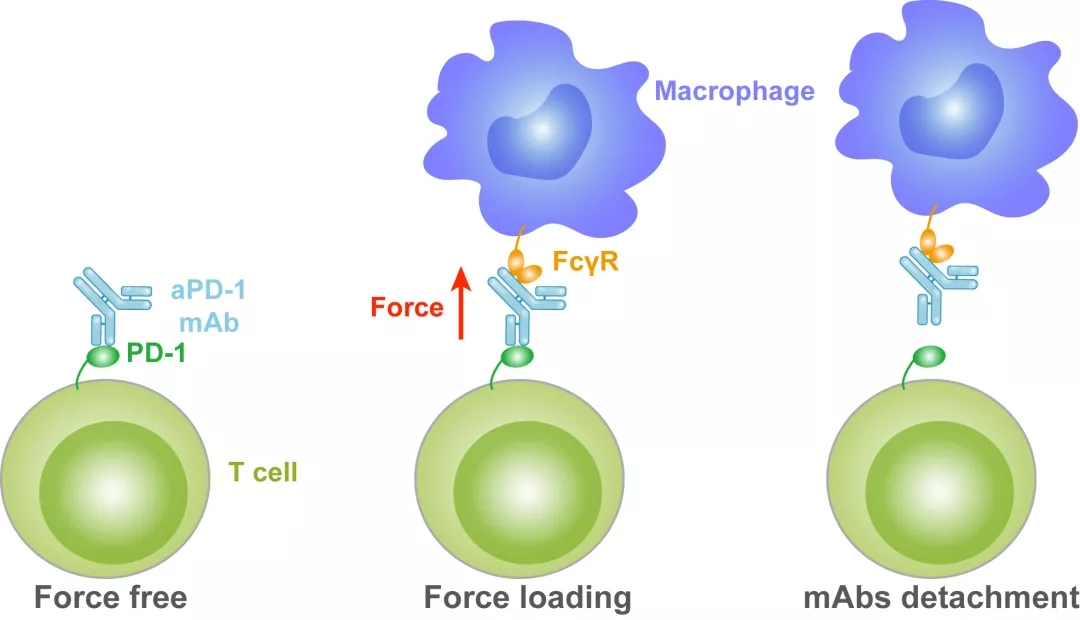
图2. 生物力调控免疫PD-1抗体与PD-1原位动态互作示意图
免疫治疗抗体在进入体内后会被巨噬细胞表面的FcγR受体捕获,抗体—抗原相互作用受到生物力的调控
此外,该系统还可应用于其他强相互作用细胞原位的解离速率及其力稳定性的测定;例如,双特异性抗体(Bispecific antibody)与其对应抗原之间、超强膜受体—配体之间、细胞骨架相关蛋白之间等较强的蛋白质—蛋白质相互作用。
陈伟教授自2014年加入浙江大学基础医学院以来,利用医工交叉优势,聚焦膜蛋白跨膜信号动态传导机制研究以及单分子生物力学方法的研发。课题组成员利用单分子生物膜力学探针及磁镊系统,在Molecular Cell、eLife等国际顶级专业期刊上发表重要研究成果。而该论文的发表是陈伟教授研究团队在传统的单分子力谱检测技术上的上又一重要突破。

陈伟课题组成员
陈伟(右五)、胡炜(右二)、安宸毅(右三)
该研究获得国家科技部蛋白质重大研究计划项目、国家自然科学基金委、浙江大学等资金的大力支持。同时,感谢浙江大学医学部、工学部(机械工程学院等)、信息学部(生仪学院等)、浙江大学医工交叉研究生培养项目以及浙江大学附属一院、悉尼大学多位教授的支持与帮助。浙江大学机械工程学院博士研究生安宸毅、基础医学院博士后胡炜为该论文的共同第一作者,浙江大学基础医学院陈伟教授、悉尼大学居理宁助理教授、浙江大学附属一院方维佳主任为该论文的共同通讯作者。