人类基因组在受到紫外线(UV)照射或是面临酒精代谢物乙醛、化疗药物丝裂霉素C(MMC)等刺激时会发生DNA交联损伤(分别为DNA链内交联损伤及DNA链间交联损伤)。如果这些DNA损伤不能得到及时、准确的修复,将导致基因组不稳定的产生,甚至诱发皮肤癌、范可尼贫血症等重大疾病。细胞为了应对这两类DNA交联损伤,分别进化出了核苷酸切除修复(Nucleotide excision repair, NER)以及范可尼贫血症信号通路(Fanconi anemia pathway, FA pathway)以维持基因组的稳定性。
XPF-ERCC1核酸酶复合体参与了这两类重要的DNA交联损伤修复信号通路,其中具有核酸酶活性的亚基XPF(FANCQ)对损伤底物的切割是细胞完成修复过程的关键步骤。然而,XPF只有与其结合蛋白ERCC1形成一个紧密复合体时,才具有完整的核酸酶活性,从而使得细胞顺利通过NER与FA途径完成DNA交联损伤修复。
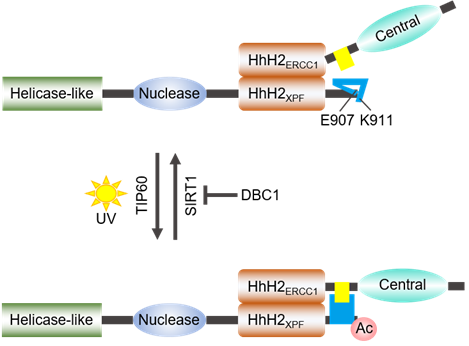
在本项研究中,刘婷研究员课题组在国际上首次报道了乙酰转移酶TIP60在DNA交联损伤发生后,催化XPF发生第911位赖氨酸残基(K911)的乙酰化修饰。XPF Ac-Lys911破坏了XPF蛋白内部的Glu907-Lys911盐桥,使得XPF末端结构打开,暴露出其与ERCC1的一个关键结合位点。这时,XPF-ERCC1复合体得以完全组装并激活,从而能够发挥其生物学功能。这一研究工作首次报道了XPF在DNA交联损伤发生后通过乙酰化修饰完成其功能性复合体精确组装的过程,为系统深入理解DNA损伤修复这一复杂的生物学过程提供了新的分子生物学依据,并为皮肤癌、范可尼贫血症等重大疾病的治疗提供了新的可能的生物学基础。
这一工作以长文形式(Article)发表于Nature Communications,题为Acetylation of XPF by TIP60 Facilitates XPF-ERCC1 Complex Assembly and Activation。在本研究论文中,2016级博士研究生王佳佳为论文第一作者,刘婷研究员为论文通讯作者。