细胞自噬(Autophagy)是指细胞在面对内外环境改变时如饥饿、缺氧、细胞器受损、外源病原体感染、蛋白聚集体产生等情况下,由一类双层膜结构包裹所需降解的物质形成自噬体,自噬体再通过与溶酶体融合形成自噬溶酶体,最终自噬溶酶体利用其酸性水解酶将自噬体包裹的物质进行降解,从而达到物质再利用的过程。自噬根据降解底物的特异性可以分为巨自噬和选择性自噬。巨自噬,也就是我们通常所讲的自噬,底物降解没有选择性。而选择性自噬则是由相应的自噬受体介导,底物降解具有选择性。研究表明,自噬在维持细胞稳态和生物有机体生长发育过程中起到重要作用。细胞自噬功能的异常与许多人类重大疾病如神经退行性疾病、II型糖尿病、脂肪肝、癌症等的发生发展密切相关。
在过去将近30年,我们对细胞自噬的认识得到了长足发展,主要研究集中在氮源饥饿、氨基酸饥饿、血清饥饿或mTOR抑制剂Rapamycin处理等情况下对细胞自噬发生的分子机制进行研究。在这一过程中,研究人员发现一系列基因参与了细胞自噬,如Atg1/ULK1复合物,Vps34复合物,Atg5-Atg12和Atg8/LC3两条类泛素化系统等;同时发现了信号通路mTOR、PKA参与了细胞自噬的发生。而我们对于另外一条受能量感受器AMPK信号分子调控的重要自噬诱导途径—能量匮乏诱导的细胞自噬发生却知之不多,研究大多停留在AMPK磷酸化某个底物(如ULK1, Beclin1, GAPDH等)从而参与能量匮乏诱导的自噬发生。对于其参与的特异性蛋白机器、降解底物和生理功能等重要生物学问题尚待解答。
2020年1月23日,浙江大学基础医学院易聪课题组在《Autophagy》上发表了题为“Atg11 is required for initiation of glucose starvation-induced autophagy”的研究论文。该研究发现Atg11,一个选择性自噬标记蛋白,为能量匮乏诱导的自噬所必需。在能量匮乏情况下,Atg11以一个多功能启动子的角色参与能量匮乏诱导自噬的起始。Atg11通过调控Snf1/AMPK与自噬蛋白激酶Atg1的互作参与Atg1的激活;通过调控Atg17与Atg29-Atg31的互作参与Atg17-Atg31-Atg29三元复合物的形成,影响整个自噬前体的形成;通过其569位的异亮氨酸招募Atg9小泡到自噬前体上,使其提供自噬体膜的来源启动后继自噬步骤;通过其CC1、CC2和CC3结构域与Atg1复合体中的Atg1、Atg29和Atg31互作;通过其CC4结构域介导Snf1/AMPK与Atg1的互作。
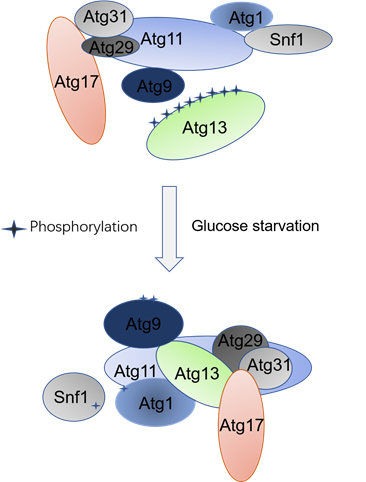
Atg11参与能量匮乏诱导自噬起始的模式图
该研究通过阐述Atg11蛋白作为一个多功能的支架蛋白特异参与了能量匮乏诱导自噬的起始,表明能量匮乏诱导的自噬与氨基酸饥饿、血清饥饿诱导的自噬在蛋白质机器组成和运行上具有差异性,为我们进一步深入了解能量匮乏诱导自噬的分子调控机制和生理功能提供了理论依据。浙江大学医学院生物化学系、浙江大学附属第一医院肝胆胰外科系研究助理姚伟静为本文第一作者,易聪研究员为本文的通讯作者。本项目得到了浙江大学刘伟教授、孙启明教授、赵经纬教授、夏宏光研究员、杨帆研究员、洪智研究员、吴李鸣医生、钟会明医生、武汉大学崔逸仙教授、清华大学俞立教授的大力支持和帮助。浙江大学医学院公共实验平台、浙江大学电镜中心为本项目的实施提供了技术支持。本课题受国家自然科学基金、科技部蛋白质机器重大研发计划等项目资助。
原文链接: https://www.tandfonline.com/doi/full/10.1080/15548627.2020.1719724