美国东部时间2019年10月24日,浙江大学基础医学院郭江涛课题组在Science杂志上发表题为“Cryo-EM Structures of the Human Cation-Chloride Cotransporter KCC1”的研究论文,解析了人源钾-氯共转运蛋白KCC1 2.9Å的高分辨冷冻电镜结构,揭示了KCC1共转运钾离子和氯离子的分子机理,为相关疾病治疗和药物设计提供了新的视角。
阳离子-氯离子共转运蛋白利用细胞膜内外侧的阳离子电化学梯度将阳离子和氯离子同时从细胞膜一侧转运至另一侧。根据转运离子种类的不同,阳离子-氯离子共转运蛋白可以分为三类,分别为钠-钾-氯共转运蛋白、钠-氯共转运蛋白和钾-氯共转运蛋白。KCC利用细胞膜内外两侧的钾离子浓度梯度将细胞内的钾离子和氯离子共转运至细胞外。KCC不但可以调节细胞体积、承担肾小管的重吸收作用,而且调控神经元细胞内部氯离子浓度和神经元的兴奋性,是临床上治疗癫痫等疾病的药物靶点。
研究人员通过单颗粒冷冻电镜技术解析了三个人源KCC1的原子分辨率结构。KCC1的跨膜区与胞外区结构域参与二聚体的形成。通过分析不同条件下的2.9 ~ 3.5Å的高分辨结构,研究人员在KCC1结构中鉴定出一个钾离子和两个氯离子的结合位点。结合离子转运实验、分子动力学模拟、结构比较等方法,阐明了KCC1以1:1的比例同向转运钾离子和氯离子的机理。最后,基于该项工作,研究人员提出了一个KCC1共转运钾离子和氯离子的模型。该研究为临床上治疗癫痫等相关疾病提供结构信息,对相关新型药物的研发具有重要意义。
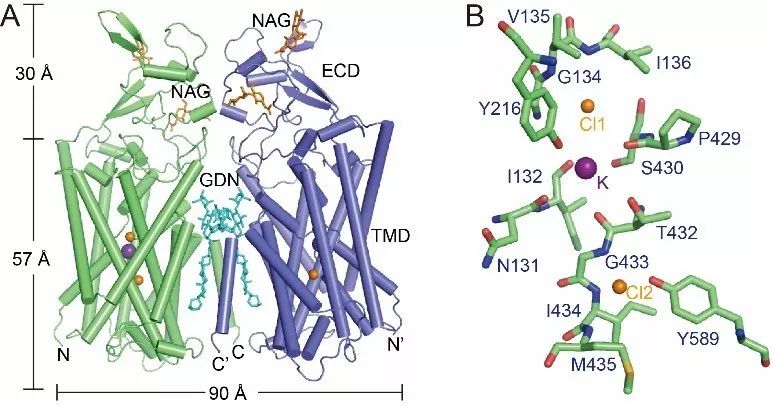
人源KCC1的结构。(A)KCC1的二聚体结构;(B)KCC1的钾离子与氯离子结合位点。
该研究工作主要由浙江大学基础医学院生物物理学系郭江涛团队、德克萨斯大学西南医学中心白晓辰团队、天津大学叶升团队、范德堡大学Eric Delpire团队以及浙江大学物理学院李敬源团队合作完成;刘斯、常圣海、韩斌铭为共同第一作者。该工作得到了浙江大学基础医学院杨巍教授、冷冻电镜中心主任张兴教授的帮助。
