DNA复制是遗传信息传递和生命延续的关键过程。然而,细胞内外的代谢活动及多种损伤因素可能引发复制压力,干扰DNA复制的正常进行,导致基因组不稳定性,并诱发多种疾病。为应对复制压力,细胞演化出多种保护机制以维护基因组的完整性和稳定性。其中,复制叉翻转(fork reversal)是一种在进化中高度保守的策略。在这一过程中,新合成的子链DNA与母链分离并翻转,两条子链相互配对,同时母链重新结合,使复制叉回退,从“三链”结构转变为“四链”结构。通过这一机制,复制叉在复制压力下得以保持动态平衡,避免崩塌,从而在高等真核生物中维持基因组稳定性。
当复制压力解除后,翻转复制叉必须重新启动以完成DNA复制。DNA2作为一种结构特异性核酸酶,在复制叉重启中发挥核心作用。DNA2通过适度切割翻转复制叉上翻转臂的5’DNA末端,生成足够长度的3’DNA突出(3’overhang),为依赖同源重组的复制叉重启提供必要的结构。然而,DNA2活性失控可能导致翻转臂的过度降解,从而引发复制叉崩塌和基因组不稳定。因此,复制压力应答过程中需要精准调控DNA2的活性:一方面细胞需要需避免DNA2对翻转复制叉末端的过早切割以维持其稳定;另一方面又需激活DNA2以有效加工翻转复制叉,保证后续复制叉重启的顺利进行。然而,这一过程中DNA2活性的动态调控机制仍未得到明确解析。
传统观点认为,BRCA1/2蛋白通过招募RAD51形成核纤丝,保护翻转复制叉暴露的末端免受DNA2、MRE11等核酸酶降解。在BRCA1/2缺陷细胞中,由于复制叉保护机制受损,细胞对复制压力的耐受性显著降低。这一缺陷导致BRCA1/2缺陷细胞对PARP抑制剂(PARPi)表现出上千倍的高敏感性,成为PARPi治疗肿瘤的基础。仅依赖BRCA1/2-RAD51的保护是否足以维持翻转复制叉的稳定性?部分PARPi耐药病人并未出现BRCA1/2功能的恢复,或许提示了其它未知保护机制存在的可能性。
2024年12月19日,浙江大学基础医学院刘婷团队在 Molecular Cell 杂志在线发表题为Dynamic Control of RNA-DNA Hybrid Formation Orchestrates DNA2 Activation at Stalled Forks by RNAPII and DDX39A 的研究论文。这项研究首次鉴定出一段RNA-DNA杂交链为翻转复制叉的重要保护因子,揭示了不同于BRCA1/2-RAD51的翻转复制叉末端保护机制。通过揭示 RNAPII-DDX39A 轴对 RNA-DNA 杂交链丰度的动态调控,该研究阐明了 RNA-DNA 杂交链在保护翻转复制叉免受 DNA2 过度降解中的关键作用,以及通过 DDX39A 移除 RNA 链,有序激活 DNA2 以促进复制叉重启,从而维持基因组稳定性的机制。

研究团队在翻转的停滞复制叉上发现了 RNA-DNA 杂交链,并通过 dot blot、PLA、EdU 偶联染色质免疫沉淀及链特异性 DNA 和 RNA 测序(EipNA-seq)等技术,证实该杂交链中的 RNA 是以后滞链为模板,在新生 DNA 的前导链上合成的。进一步研究表明,这一RNA-DNA 杂交链的合成由 RNA 聚合酶 II(RNAPII)介导完成。而解旋酶DDX39A特异性解旋该杂交链,移除RNA,招募DNA2对翻转复制叉末端进行加工,促进复制叉重启。
通过抑制RNAPII或过量表达DDX39A以降低停滞复制叉处杂交链的丰度,研究者观察到复制叉被DNA2切割后过度降解并崩塌,同时伴随大量DNA损伤信号的积累。这一结果表明,RNA-DNA杂交链在复制压力未解除时能够有效抑制DNA2的过早降解,从而避免复制叉崩塌和DNA损伤,确保基因组稳定性。
该研究表明,除了经典的 BRCA1/2-RAD51 介导的保护作用外,RNA-DNA 杂交链也在翻转复制叉末端的保护中发挥了重要作用。研究人员证实,在 DDX39A 缺失的情况下,RNA-DNA 杂交链得以持续存在,从而保护复制叉,部分恢复了 BRCA1/2 缺陷细胞的复制叉稳定性,导致这些细胞对 PARP 抑制剂(PARPi)产生耐药性。通过对 TCGA 数据库的分析,进一步揭示了这一机制与 BRCA1/2 缺陷卵巢癌患者接受铂类药物化疗后不良预后之间的关联。这一发现提示,DDX39A 的表达水平可能成为化疗药物疗效的潜在预测指标。此外,通过采用特异性策略阻断 RNA-DNA 杂交链对翻转复制叉末端的持续保护,有望逆转由此机制引发的 PARPi 耐药问题。
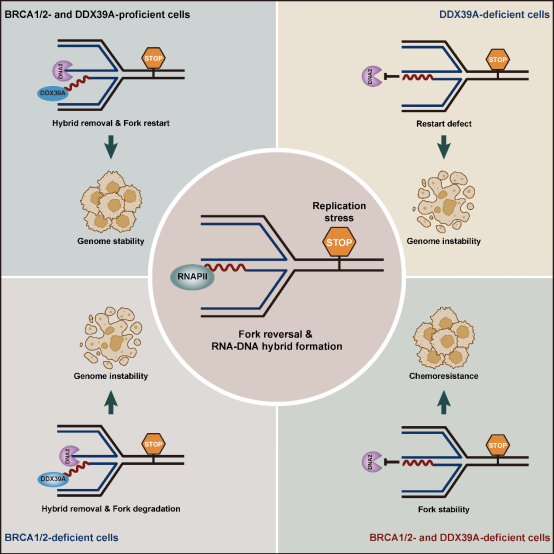
综上所述,这项研究的发现不仅拓展了我们对复制压力应答机制的认识,也为靶向复制叉动态调控以开展肿瘤精准治疗提供了新的思路,尤其是为克服BRCA1/2缺陷癌症中的PARPi耐药性提供了潜在的治疗策略。
浙江大学刘婷教授为本文通讯作者,浙江大学博士生宋礼志、谢海华、樊浩楠、博士后张燕君、已毕业博士生程子修为本文共同第一作者。该研究工作还得到了浙江大学方东教授团队、黄俊教授团队和浙江大学医学院附属第二医院周建维教授团队的大力支持。
刘婷课题组长期致力于研究DNA损伤应答与基因组不稳定性的分子机制,通过基础研究与疾病模型相结合的方法,深入探讨与DNA损伤应答相关疾病的分子机制,并探索更有效的靶向治疗策略。研究成果发表于Science、Molecular Cell、Nat Chem Biol、Nat Commun、Proc Natl Acad Sci U S A、EMBO J、Cell Rep、EMBO Rep.等知名学术刊物,诚邀对该领域有兴趣的学生、博士后、技术员等加盟。课题组详细信息请见网站https://person.zju.edu.cn/tliu,申请可发至liuting518@zju.edu.cn。










