浙江大学2021年度十大学术进展评选开始啦!
为进一步提升学校学术声誉,搭建学术交流平台,营造互相欣赏的卓越学术文化,服务学校“双一流”建设,浙江大学学术委员会组织开展的“浙江大学2021年度十大学术进展”已进入评选阶段。
今年全校各学部、学院和科研机构共有42项学术进展参与评选,我院陈伟教授团队《新冠病毒刺突蛋白的力学调控机制及新型抗体治疗策略》及张岩教授团队《“快乐”神经递质受体的结构药理学研究》参评,快来为他们投上宝贵的一票吧~
评选事项
A.微信点赞,支持欣赏的项目
✔点赞方式:公众号“求是风采”每天推出7个候选项目的简介,点击推文文末右下角“点赞”图标即可参与点赞。

✔统计3天内的点赞数,以10%权重列入“十大学术进展”评选计分排名。
✔推文推出顺序随机排列,排名不分先后。
B.网络投票,赢取“最佳鉴赏”奖
✔投票方式:每位浙大师生可以通过浙大通行证登录十大学术进展评选网站http://xspx.zju.edu.cn/xspx/或扫描下方二维码,为您欣赏的研究“投票”。

✔投票时间:3月29日-4月8日
✔与“年度十大学术进展”评选结果重合度最高的师生,将获评“最佳鉴赏奖”。
✔42个项目为随机排列,排名不分先后。

陈伟教授团队
项目名称:新冠病毒刺突蛋白的力学调控机制及新型抗体治疗策略



项目团队:
陈伟教授团队长期致力于研究生物力对蛋白质的动态调控规律,突破生命科学领域传统研究手段的限制,自主研发了“多谱相”及“超稳”单分子力谱技术,在细胞膜原位精准表征生物力调控下的膜蛋白配体识别及其耦合的跨膜信号转导的动力学规律,授权9项国家发明专利;先后主持了国家科技部蛋白质重大研究计划“青年项目(青年 973)”(2014)和国家自然科学基金委“优秀青年项目” (2015)等项目,积极参与新冠疫情相关基础研究,利用单分子力谱技术,揭示了力学-化学耦合动态调控T细胞受体 (T-cell receptor, TCR)非我抗原识别以及新冠病毒入侵等分子机制,提出新型阻断新冠病毒入侵的策略,为阐明诸如重大疾病的免疫应答、新冠病毒感染等规律及肿瘤免疫治疗、新冠疫情防治等提供重要的理论基础; 获得了一系列国内外同行认可的学术成绩。
项目简介:
新冠病毒的刺突蛋白spike识别宿主细胞受体ACE2,触发其S1和S2结构域分离,促进病毒入侵,但其中的分子机制并不清楚。本研究结合生物化学和生物物理技术,首次揭示了生物力增强spike/ACE2相互作用并加速S1/S2结构域的分离,促进病毒入侵的分子机制。
科学解读:
新冠病毒(SARS-CoV-2)利用其刺突(spike)蛋白识别宿主细胞受体(如ACE2),引起spike中的S1与S2结构域分离,触发S2结构域的构象改变,最终导致病毒与宿主细胞膜融合从而完成病毒入侵。但是,目前结构生物学研究发现新冠病毒spike结合ACE2受体时仅RBD结构域存在较大构象改变,其它部分只发生了细微的变化,并不足以触发紧密结合的S1和S2结构域分离。因此,新冠病毒spike结合宿主受体如何触发其S1和S2结构域的分离,进而激发S2膜融合蛋白机器,是冠状病毒入侵领域悬而未解的重要问题之一。
2021年08月31日,国际权威专业期刊《Cell Research》在线发表了题为“Mechanical activation of spike fosters SARS-CoV-2 viral infection”研究论文,成为第10期封面论文。研究者通过生物力学理论计算,得到新冠病毒入侵过程中,病毒边缘单个spike/ACE2分子对受到10~30皮牛(1皮牛=10-12牛顿)级别大小的生物拉力;结合分子动力学模拟、单分子力谱技术及假病毒感染实验首次证明了生物力可以增强spike/ACE2相互作用并加速S1与S2结构域的分离,促进病毒入侵宿主细胞。
该论文揭示了生物拉力在新冠病毒颗粒通过spike/ACE2相互作用入侵宿主过程中的重要作用。病毒入侵过程中所产生的生物拉力能量主要源自于spike/ACE2互作所释放的一部分自由能。该能量进一步转换成为细胞-病毒系统的弹性势能。其主要包括两部分:1、细胞膜内存储一部分弯曲能,主要由相对柔软的细胞膜适应较硬病毒颗粒的形貌,包裹在其表面所储存;2、为保证病毒与细胞膜的紧密贴附,细胞-病毒接触面边缘的spike/ACE2分子键中存在着生物拉力,从而存储部分拉伸弹性势能。单分子力谱实验进一步证明新冠spike/ACE2相互作用在皮牛量级拉力作用下显著增强。分子动力学模拟显示,拉力将导致新冠病毒spike中与ACE2结合的结构域RBD发生转动,增强了spike/ACE2键的结合,延缓了它们的解离,从而增强病毒颗粒附着于表达ACE2细胞表面。而且,这种力学增强spike/ACE2互作效果在新冠spike上比非典病毒spike上更加显著,为新冠病毒比非典病毒更强的传染力提供了全新的分子机制解释。
更有意思的是,生物拉力还能成千倍地加速S1与S2结构域的分离。研究者还意外地发现了传染性较强新冠病毒突变株刺突上D614G的突变(该突变为阿尔法、贝塔、德尔塔、伽马及拉姆达毒株共有的突变)能够进一步3倍增强spike与ACE2受力结合,并35倍加速S1与S2结构域分离速率。该发现为解释D614G相关的高致病性毒株高传染性提供了全新的分子机制解释。
此外,该研究还鉴定了一种来自COVID-19康复患者的、具有较好中和能力的、同时结合S1与S2结构域的非RBD阻断的单克隆抗体,该抗体可以105倍抑制S1与S2结构域受力快速解离。基于上述研究发现,研究人员提出了一种全新的基于锁定刺突蛋白S1与S2结构域来中和冠状病毒的抗体筛选及设计概念,潜在性为目前新发的高致病性新冠突变毒株提供全新的有效阻断策略。为治疗新冠病毒提供理论基础和技术支持。2021年10月6日, 国际著名期刊《Nature Cell Biology》在线发表了“Force boosts SARS-CoV-2 invasion”的评论,积极评价了论文在应用生物物理方法解析生物力促进新冠病毒入侵宿主细胞的分子机制,并提出全新的中和抗体概念的创新性和临床意义。
阿里巴巴和浙江大学以“合作办学、合作育人、合作创业、合作发展”的互惠互利、优势互补原则,成立阿里巴巴-浙江大学未来数字医疗联合研究中心(Alibaba-Zhejiang University Joint Research Center of Future Digital Healthcare)。2021年11月2日,资助本项研究的阿里巴巴公益基金会为陈伟教授团队制作了成果介绍视频,充分肯定了陈伟教授在新冠病毒基础研究领域取得的成果和做出的贡献。
项目名称:“快乐”神经递质受体的结构药理学研究


项目团队:
项目负责人张岩,长江学者,浙江大学医学院长聘教授,博士生导师,国家重点研发计划首席青年科学家,国家优青,浙江省杰青。张岩团队长期从事重大疾病相关药物靶标GPCR 信号转导机制与结构药理研究,发展并奠定了基于冷冻电镜的GPCR结构药理学。系统研究了GPCR结构药理、激活机制、功能择性信号转导和调控机制等,开展结构导向的药物理性设计,在相关领域取得了具有国际影响力的原创性和系统性成果。累积发表SCI论文40余篇,其中,近五年来通讯作者论文23篇(总影响因子630),包括Nature(5篇)、Science(2篇)、Cell等;第一作者论文6篇,包括Nature(3篇)等。工作受到国际同行广泛关注和好评,10余次 F1000推荐;8篇文章入选高被引论文,1篇论文入选热门论文;3篇主要作者论文引用超过300次,总引用数超过3000(谷歌学术)。国际大会发言7次,国际国内受邀报告超过40次。
项目简介:
神经递质系统与各种负面情绪和脑疾病的高度相关。系统性阐释神经递质受体在配体识别和激活调控等问题,将为开发抗抑郁等重大精神疾病药物提供关键的结构和理论基础。
科学解读:
你是否想过,你的开心或难过可能是身体内的一些微小化学物质在发挥作用?这些化学物质是如何影响人们的情绪,在大脑中发挥神奇的作用呢?
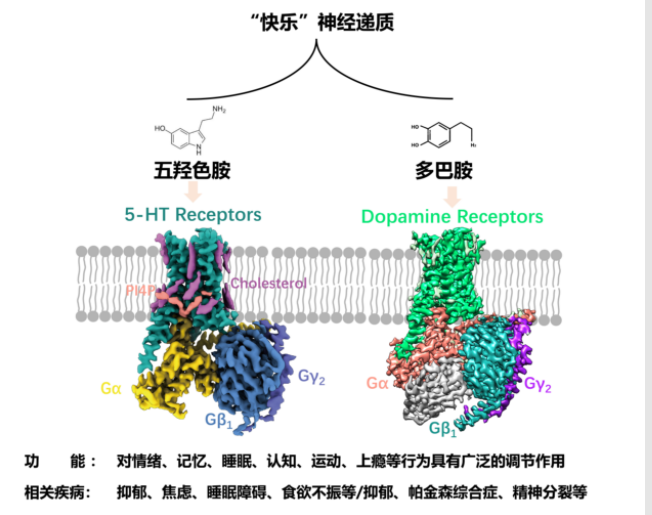
血清素、多巴胺、内啡肽,是人类快乐最重要的三种物质。
血清素,又名5-羟色胺 (5-HT),是一种可以产生愉悦情绪和幸福感的信使分子,因此也被称为“快乐激素”,其在人体内含量的变化常常与情绪的变化有关,比如血清素的缺乏会导致抑郁的发生。血清素,是一种被广泛研究的神经递质,几乎影响到大脑活动的每一个方面:从调节情绪、精力、记忆力到塑造人生观。中枢神经系统血清素含量变化、功能异常可能与精神病、偏头痛等多种疾病的发病有关。血清素通过作用于相应的受体的介导方能产生作用,其受体在人体中有十几种不同亚型,包括血清素受体1A、1B 、1D、1E等,分布在不同的脑区,介导兴奋性和抑制性的神经传递。已有的研究发现,血清素与其受体结合能够产生幸福感,使人远离焦虑。血清素受体1A是临床药物靶向最为集中的亚型,是临床治疗精神分裂和抑郁症的药物阿立哌唑(aripiprazole)的主要药物靶标。血清素受体1D与血清素受体1B具有高度序列同源性,同时也是曲坦类抗偏头痛药物的作用靶标;血清素受体1E与记忆有关。此外,即使大脑没有分泌血清素来激活其受体,人体也会保持一定的幸福感。血清素是如何让人产生幸福感?为什么没有分泌血清素来激活其受体,人体也会保持一定的幸福感?不同地血清素受体亚型被激活的分子机制有什么差异?这些问题都亟待解决。
而多巴胺(dopamine, DA)是人体中枢神经系统和周围神经系统的主要神经递质之一,通过结合多巴胺受体发挥众多重要的生理功能,包括调控学习、记忆和认知,调节情绪和控制运动等。多巴胺信号转导的失衡和改变是导致多种精神类疾病的原因之一,这些疾病包括帕金森症(Parkinson's disease)、精神分裂症、图雷特氏综合症和亨廷顿氏病等。多巴胺受体家族包含五个成员:DRD1、DRD2、DRD3、DRD4和DRD5。其中,DRD1和DRD5属于D1类受体,与激活型G蛋白Gs偶联,刺激第二信使cAMP的产生;而DRD2、DRD3和DRD4属于D2类受体,与抑制型G蛋白Gi/o偶联,抑制第二信使cAMP的生成。DRD1、DRD2、DRD3都是帕金森疾病治疗药物的靶点,帕金森综合症是一类慢性神经退行性疾病,临床表现为静止性震颤、肌强直、运动迟缓和姿势平衡障碍以及认知问题等。帕金森综合症的病理特征是大脑黑质致密区多巴胺神经元的变性死亡,从而引起纹状体多巴胺神经递质分泌显著减少。
因此,目前帕金森综合症的主要疗法是补充多巴胺神经递质(前体)或者多巴胺受体激动剂以缓解临床症状,如左旋多巴(Levodopa,L-DOPA)和溴隐亭(Bromocriptine)。从根本上治愈帕金森综合症取决于对其真正起因的探究,解析多巴胺受体信号的分子机制是理解帕金森综合症分子基础的重要一环,也是改善当前帕金森综合症疗法的有效途径。药物是如何作用于不同的受体,又是如何激活不同的下游信号发挥作用,从分子层面阐述这些问题,对于精准药物开发极为重要。
看完两位老师团队的项目介绍
是不是更加迫不及待想要
为他们加油打CALL啦
微信点赞+十大学术进展评选网站投票
快快行动起来吧!











