北京时间2019年7月2日,浙江大学基础医学院免疫学研究所王建莉/蔡志坚课题组在《Nature Communications》在线发表题为“Fas signaling-mediated TH9 cell differentiation favors bowel inflammation and antitumor functions”的研究论文,该研究揭示了Fas蛋白在调控TH9细胞分化及炎症、抗肿瘤中的关键调控作用。
论文链接:
https://www.nature.com/articles/s41467-019-10889-4
T细胞治疗是诸多肿瘤免疫治疗类型中最强有力的方案之一。早期研究多以CD8+ T细胞为主,而CD4+ T细胞介导的免疫疗法较少。白介素9分泌型CD4+ T细胞(TH9)是一群新发现的具有抗肿瘤作用的T细胞亚群。2018年6月,Cancer Cell曾发文报道TH9细胞的抗肿瘤效果要明显优于TH1和TH17细胞,回输一次TH9细胞就能彻底治愈晚期的B16小鼠黑色素瘤,并能完全抑制再次接种肿瘤在小鼠体内的生长,表明其重要的抗肿瘤前景。
Fas(Apo-1,CD95)和Fas配体(Fas-ligand,APO-1L,CD95L,TNFSF6)是典型的肿瘤坏死因子(tumor necrosis factor,TNF)受体和TNF配体超家族成员。Fas信号通路除了介导T细胞凋亡,还可以参与T细胞的增殖和活化。已有研究显示Fas促进TH17细胞分化,抑制TH1细胞极化,而Fas是否参与了TH9细胞的分化调控,尚不完全清楚。
课题组应用Fas及FasL缺失小鼠,结果发现Fas及FasL敲除后小鼠的TH9细胞极化水平明显降低。进一步的机制探讨显示,Fas通过Ca2+依赖性PKC-β激活NF-κB从而促进TH9细胞分化。此外,PKC-β通过上调p38磷酸化水平使NFAT1失活,抑制NFAT1-NF-κB协同促进TH9细胞极化水平,起到负反馈调控作用。Fas通过促进TH9细胞分化加重肠炎,Fas联合p38抑制剂明显提高TH9细胞的抗肿瘤能力。低剂量的p38抑制剂抑制肿瘤生长且无全身副作用。TH9细胞水平高的临床NSCLC病人预后较好。因此,本项研究揭示了Fas非凋亡信号调控的TH9细胞在自身免疫性疾病及肿瘤治疗中的作用,对改进自身免疫性疾病及肿瘤免疫治疗提供了新的可能。
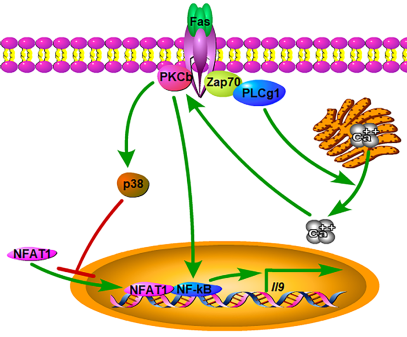
Working model of Fas-signaling to control TH9 cell differentiation
浙江大学免疫学研究所博士后沈颖颖为该研究的第一作者。王建莉教授和蔡志坚教授为该论文的通讯作者。此项研究得到了国家自然科学基金、国家重大科技专项及国家重点基础研究发展规划项目 (973计划项目)的支持。











