北京时间2019年6月18日,浙江大学基础医学院免疫所曹雪涛院士团队在 《Cell Research》 在线发表题为“Interferon-inducible cytoplasmic lncLrrc55-AS promotes antiviral innate responses by strengthening IRF3 phosphorylation”的研究论文,该研究鉴定了一种新的细胞质长非编码RNA(lncRNA),lncLrrc55-AS,它驱动正反馈环以促进干扰素调节因子3(IRF3)信号传导和IFN-I产生。
原文DOI:https://doi.org/10.1038/s41422-019-0193-0
天然免疫反应是宿主防御入侵病毒的第一道防线。模式识别受体识别病毒组分并激活下游信号,包括IRF3和NF-κB途径。IRF3的激活诱导I型干扰素(IFN-1)的产生,在宿主防御病毒入侵中起关键作用。上游信号分子(例如,TBK1,IKKε)能够介导IRF3磷酸化,随即二聚化和核转位,并进一步调节IFN-1的表达。蛋白磷酸酶2A(PP2A)通过介导IRF3去磷酸化,从而负向调节IFN-I的产生。如何精确平衡IRF3的磷酸化和去磷酸化以确保适当的IFN-I产生,同时避免组织损伤的机制尚不完全清楚。
表观遗传调节因子在免疫细胞功能的调节以及免疫疾病的发病机制中发挥重要作用。长链非编码RNA(lncRNA)也是天然免疫和适应性免疫的关键调节因子。 一些核内lncRNA通过直接与染色质修饰因子,异质核糖核蛋白(hnRNPs)或转录因子相互作用来 调节免疫相关基因的转录;同时,其他lncRNA通过参与形成多亚基复合物来调节先天免疫应答途径。另一方面,已有研究显示,细胞浆lncRNA通过调节翻译后修饰(PTM)或细胞代谢来控制信号组分的活性。此外,一些差异表达的lncRNA调节炎症先天反应,病原体逃逸,或病原-宿主相互作用。此外, lncRNA还可以与信号分子相互作用,以控制不同的生物过程。
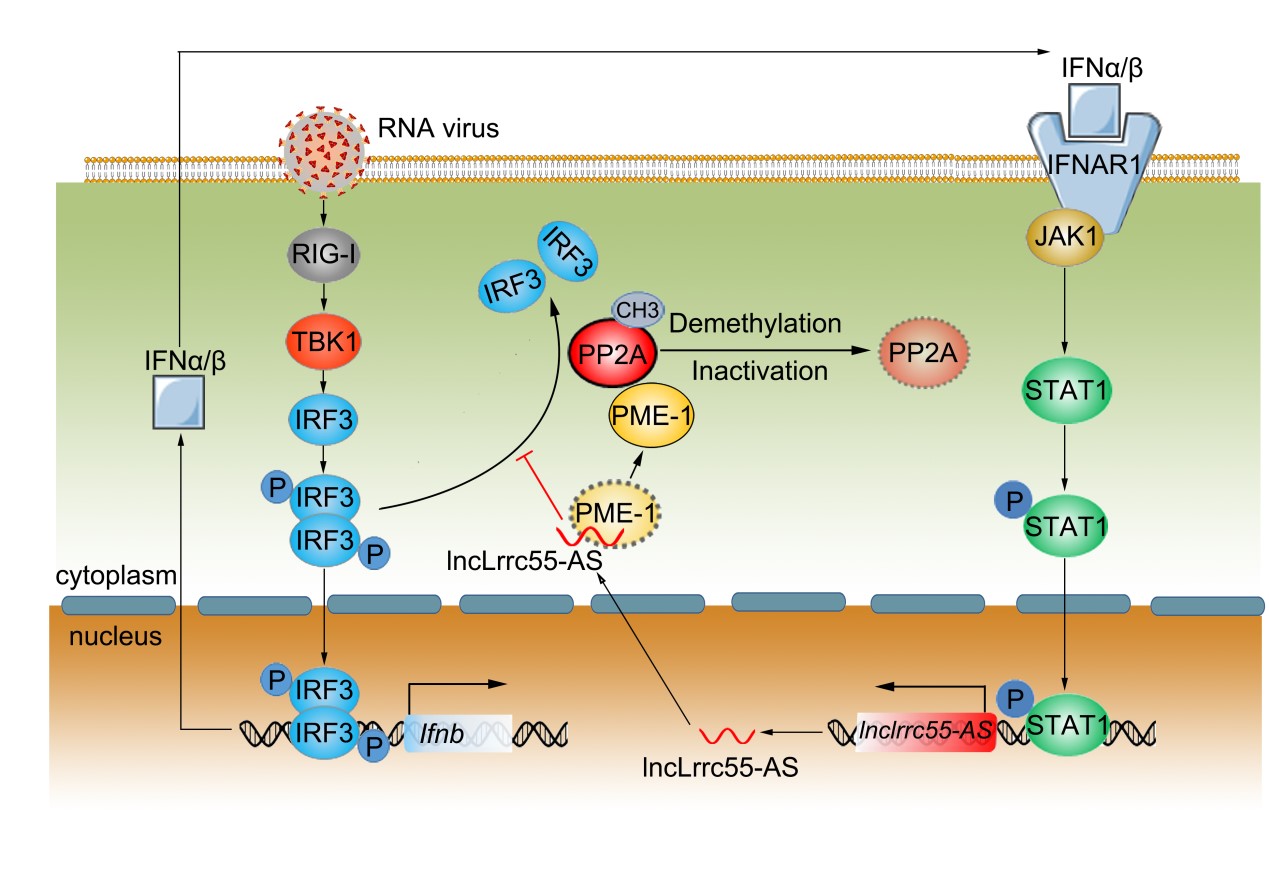
在本团队先前的研究中,病毒感染能够诱导IFN-I依赖性lncRNA lnc-lsm-3b和IFN-I非依赖性lncRNA lncRNA-ACOD1的表达,其通过不同机制调节先天反应和病毒复制。本研究鉴定了一种新的细胞浆定位的长非编码RNA(lncRNA),lncLrrc55-AS,它驱动正反馈环以促进IRF3信号传导及IFN-I产生。该研究显示lncLrrc55-AS依赖IFN-JAK-STAT途径在多种细胞类型中被病毒诱导。 LncLrrc55-AS缺陷型小鼠显示出弱化的抗病毒免疫应答,并且更容易受到病毒攻击。机制上,lncLrrc55-AS结合磷酸酶甲酯酶1(PME-1),并促进PME-1与磷酸酶PP2A(IRF3信号传导的抑制剂)之间的相互作用。 LncLrrc55-AS促进PME-1介导的PP2A去甲基化和失活,从而增强IRF3磷酸化和信号传导。总而言之,本研究鉴定出IFN诱导的lncRNA作为IFN-1产生的正调节因子,增加了对先天免疫和炎症中lncRNA介导的信号传导调节的机制洞察。
浙江大学基础医学院周玉梅博士为该研究的第一作者,曹雪涛院士为该论文的通讯作者。该研究得到国家自然科学基金面上项目,国家重点研究开发项目及中国医学科学院医学科学创新基金的资助。











