北京时间2019年6月18日,杨巍教授课题组在《Cell Reports》期刊在线发表了题为“Direct gating of the TRPM2 channel by cADPR via specific interactions with the ADPR binding pocket” 的研究论文,揭示了NAD代谢产物cADPR(环腺苷二磷酸核糖)的钙离子调节新机制。原文链接:https://doi.org/10.1016/j.celrep.2019.05.067
NAD是一种重要的生物能量调节和信号通路调控因子,作为细胞和组织内稳态的关键调节因子,该分子及其代谢产物(包括腺苷二磷酸核糖ADPR、环腺苷二磷酸核糖cADPR和烟酸腺嘌呤二核苷酸磷酸NAADP等)已被证实,可通过调节多种钙离子通道在细胞信号传导中起作用,进而介导多种生理病理功能。
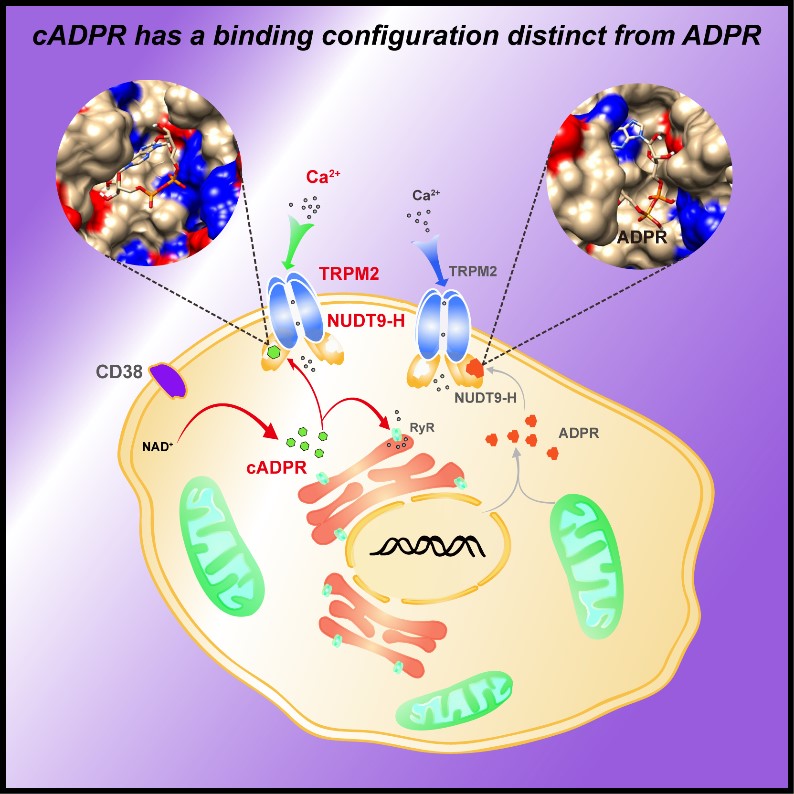
其中,cADPR被认为通过调节Ryanodine受体(RyRs)的功能来引发肌浆网Ca2+释放,在肌肉收缩、胰岛素释放、神经递质分泌和卵母细胞受精等多种细胞过程中扮演第二信使角色。尽管已有研究发现,该分子也可介导胞外Ca2+内流,但其分子机制并不清楚。
近年来研究发现cADPR可能是TRPM2通道激动剂,但在该领域仍然存在争议。本研究通过自主合成纯化的cADPR分子,运用全细胞和单通道电生理记录表明cADPR可诱发瞬时电位受体家族TRPM2通道的电流,进一步运用表面等离子共振技术(SPR)直接证明了cADPR分子能够特异性结合到TRPM2通道NUDT9-H配体结合区。同时,利用水解酶活性测试排除了cADPR分子通过酶促反应转变为其他NAD代谢产物进而激活TRPM2通道的可能性。进而,通过综合运用计算机模拟与突变体电生理记录,发现NUDT9-H区域中H1346、T1347、L1379、S1391、E1409和L1484等六个氨基酸残基的点突变不仅显著改变了cADPR激活TRPM2通道的半数激活效应,且与TRPM2通道内源性激动剂ADPR的激活效应存在明显差异,揭示了ADPR和cADPR差异性激活TRPM2通道的分子机制。本研究首次证明了cADPR作为TRPM2通道的一种直接激活剂,并具有与ADPR激活该通道不同的分子结合模式,这不仅有助于理解TRPM2通道激活门控机制,也为阐明cADPR调控细胞内Ca2+稳态机制提供了新的研究思路。
浙江大学医学院余沛霖博士、北京大学药学院刘振明博士为该研究的第一作者,浙江大学基础医学院、浙江大学医学院附属第一医院杨巍教授为该研究的通讯作者。该研究得到了浙江大学基础医学院罗建红教授、杨帆研究员及北京大学药学院张礼和院士、张亮仁教授等的大力支持。该研究得到国家自然科学基金、科技部重大研发计划、国家重大新药创制专项及浙江省杰出青年基金等项目的资助,也得到医学院公共技术平台的大力支持。











