近日,我院干细胞与再生医学研究中心博士生姜蒙蒙关于造血干细胞再生与分化机制的研究工作荣获国际干细胞论坛最佳海报二等奖。第六届国际干细胞论坛(The 6th International Forum on Stem Cells)于10月18日-19日在天津成功召开。本届论坛是由中国医学科学院血液病医院(血液学研究所)常务副院所长程涛教授和以色列魏兹曼科学研究所Tsvee Lapidot教授共同担任大会主席,以造血干细胞相关基础,临床及转化最新进展为主题,是一场国内顶尖国际一流的学术盛会。

2018年7月和10月,浙江大学基础医学院郭国骥教授团队在Nature子刊《Cell Discovery》上在线发表2篇研究论文,分别揭示了造血干细胞再生与分化的机制。姜蒙蒙同学的海报主要展示了这两项研究工作。2018年10月30日在线发表了题为 “Maintenance of Human Haematopoietic Stem and Progenitor Cells in vitro Using a Chemical Cocktail” 的研究长文。文章发现小分子化合物组合CFO(CHIR-99021,Forskolin, and OAC1)可在体外有效维持人造血干祖细胞的干性。全文详见:https://rdcu.be/bak1L. 2018年7月3日在线发表了关于物种间造血图谱差异的研究成果 “Comparative Transcriptomic Analysis of Hematopoietic System between Human and Mouse by Microwell-Seq”,揭示了人鼠造血干细胞分化机制。全文详见:https://www.nature.com/articles/s41421-018-0038-x.
骨髓移植,即人造血干细胞(HSC)的移植,是人类史上干细胞移植的首个成功典例。同种异体的人 HSC 移植是目前治疗大量恶性血液病的唯一治疗方案。然而 30-40% 的病患会因为 HLA 找不到配型而得不到治疗。如果我们能在体外有效的扩增人造血干细胞,则能彻底解决这些问题。 HSC 体外培养体系的建立,也将使人血液系统的基因编辑和基因修复变得容易,从而打通基因治疗血液疾病的技术瓶颈。
近年来,利用小分子来控制细胞命运决定成为了研究的热点。2010年,科学家发现苯酚受体拮抗剂(SR1)能够促进人HSC的体外扩增。2014年,研究者们又发现嘧啶吲哚衍生物(UM171)能够独立于苯酚受体的信号通路,促进人HSC的体外增殖。大量筛选实验已经找到具有增殖人造血干能力的单个小分子,然而小分子组合的尝试严重缺乏。事实证明,利用小分子组合来控制细胞命运,潜力巨大。北大邓宏魁团队利用小分子化合物组合替代了所有的外援基因表达,并成功将小鼠成纤维细胞重编成为多能干细胞。这一突破性的进展打开了细胞命运控制的黑匣子。我们发现这些研究工作所涉及的信号通路基本都包括WNT,TGF-β,cAMP和组蛋白修饰等。他们中的一些已被证实对人HSC的扩增有促进作用,然而这些小分子的排列组合是否能更有效的扩增人HSC,尚不清楚。这些小分子与生长因子的协同作用也有待研究。除了单纯意义的扩增,这些小分子组合能否将人多潜能祖细胞(MPP)重编程为干性更强的HSC,又能否将人HSC重编程为扩增能力更强的造血干前体细胞(Pre-HSC),都是值得深入探索的问题。
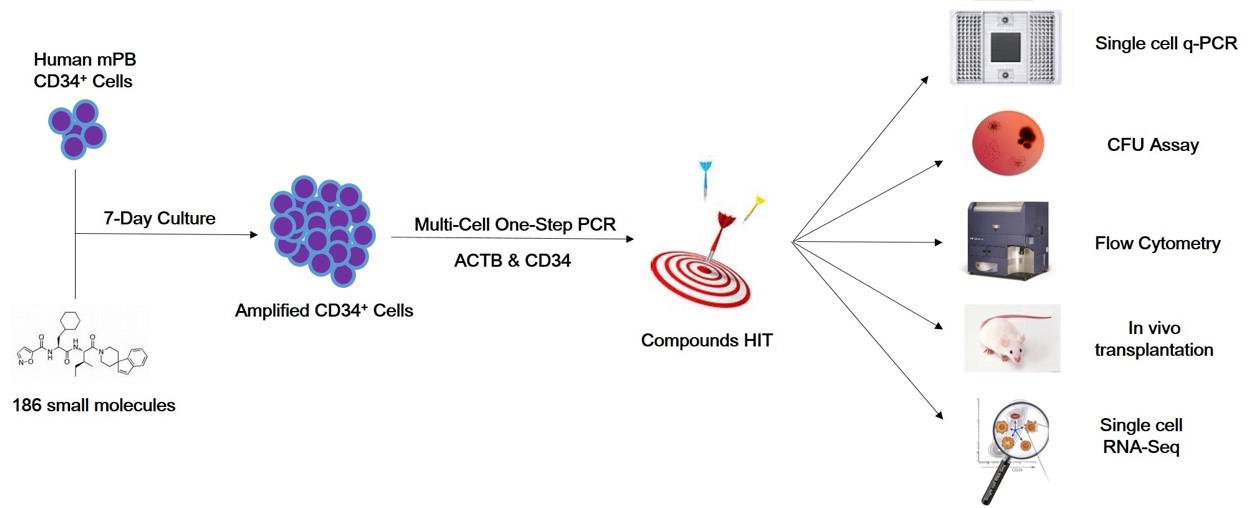
图2:实验研究设计框架
本研究依托浙江大学附属第一医院血液学研究所采集G-SCF动员后的人外周血,并富集CD34+人造血干祖细胞,通过课题组自主搭建的一步法 PCR 筛选平台 — Multi-cell One-step PCR,通过测定 ACTB 和 CD34 的表达量系统性筛选了186个促进 HSC 体外扩增的干性相关小分子,并寻找到3个促进 HSC 体外扩增的小分子化合物 CHIR-99021(C),Forskolin (F),OAC1(O)。后续调试了3个小分子化合物的浓度及单化合物,双化合物和三化合物组合的体外扩增效果,最终确定最佳小分子化合物组合 CFO。随后,HSC 经过 CFO 处理7天后,利用高通量单细胞q-PCR方法检测96个关键造血基因的表达状况,体外克隆形成能力,流式分析 HSC(CD34+CD38-CD90+CD45RA-CD49f+)的比例,以及体内免疫缺陷小鼠(B-NDG)异种移植的嵌合能力,我们发现 CFO 可在体内外实现 HSC 的有效扩增(图1)。最后本研究利用课题组自主研发的 Microwell-seq 高通量单细胞测序平台(已发表于《CELL》杂志)解析 CFO 诱导 HSC 体外扩增的机制及相关通路(图2)。该研究的成功开展填补了小分子化合物组合调控人造血干祖细胞体外增殖的空白,也有望为人类血液系统的细胞治疗和基因治疗提供可靠的细胞来源。
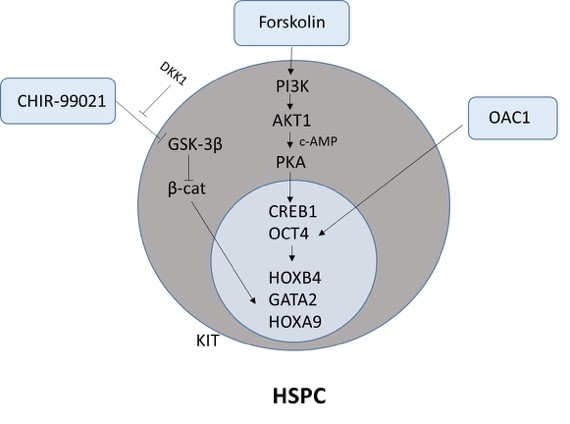
图3:小分子组合CFO体外维持人造血干祖细胞干性机制
另一项研究则从单细胞水平开创性地比较了物种间造血系统的差异,揭示了人鼠造血干细胞分化机制。我们利用Microwell-Seq高通量单细胞测序平台检测了人和小鼠共7万多个造血系统单细胞样品,绘制了人和小鼠两个物种的造血系统细胞图谱,将小鼠的基因转换成同源的人类基因,而后通过牛津大学Rahul Satija团队开发的Canonical Correlation Analysis (CCA) 算法进行物种间整合分析。我们发现了物种间共有16种不同类型的造血干祖细胞,其中6种干祖细胞在人和小鼠中均匀分布,而其他干祖细胞呈现出物种偏好性,并通过体外克隆形成实验和小鼠移植实验验证单能性造血干祖细胞的存在(图3)。总之,该研究开创性地比较了物种间造血系统的差异,我们猜想这种差异是由造血干细胞所处不同微环境而导致的。
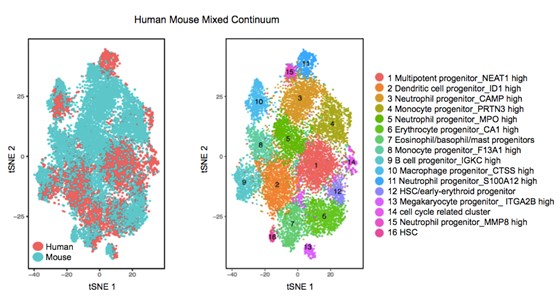
图4: 人鼠造血系统图谱异
第一篇研究通讯作者为郭国骥教授,黄河教授,韩晓平副教授,第一作者为博士生姜蒙蒙。第二篇研究通讯作者为韩晓平副教授,郭国骥教授,黄河教授,共同第一作者为博士生赖淑静,黄文韬,许杨,姜蒙蒙,陈海德。课题受到国家自然科学基金、浙江省自然科学基金杰出青年项目、科技部干细胞及转化研究重点研发计划等资助。











