近日,浙江大学基础医学院免疫学研究所曹雪涛教授课题组在免疫学杂志Immunity上发表题为“Adult Connective Tissue-Resident Mast Cells Originate from Late Erythro-Myeloid Progenitors”的研究论文。原文链接为 https://www.cell.com/immunity/fulltext/S1074-7613(18)30438-2。该论文研究发现了成体组织定居肥大细胞的发育起源和分化路线。该发现不仅更新了对肥大细胞分化发育的认识,也从发育起源的角度解释了肥大细胞的异质性,为拓展肥大细胞相关生物学研究奠定了基础。
肥大细胞广泛分布于机体的各个器官,尤其是皮肤、消化道、呼吸道血管和神经末梢的周围。基于细胞的组织分布,将肥大细胞分为结缔组织型肥大细胞(CTMC)和粘膜型肥大细胞(MMC)。自1878年德国科学家Paul Ehrlich首次发现了被碱性染料异染的富含颗粒的肥大细胞以来,其以介导I型过敏性疾病而被人们所熟知。在生物进化的历史长河中,肥大细胞出现于脊索动物体内,在物种进化中高度保守,提示其具有重要的生理功能。以往关于肥大细胞的研究大部分是基于c-KitW/Wv小鼠(缺乏肥大细胞),但是该小鼠还存在其他造血细胞的缺陷,因此亟待需要准确的模型来评价肥大细胞的功能。因此对于肥大细胞的研究还任重而道远。
关于组织中肥大细胞的更新和维持,目前的主流观点是:像组织中的其他免疫细胞一样(巨噬细胞除外)依赖于骨髓造血进行更新和补充。然而以上结果基于缺失肥大细胞的情况下,那么正常稳态下组织肥大细胞的维持和更新有待系统的研究。
在这项研究中,浙江大学免疫学研究所曹雪涛院士、博士生李志清与海军军医大学免疫教研室刘书逊副教授等首先运用成年小鼠及新生期小鼠的骨髓重建实验证实:不同于MMCs,CTMCs在出生前就已定居在外周组织中,能够自我更新,不依赖于后期骨髓造血的更新。基于此,研究者系统分析了新生小鼠各组织中肥大细胞的分布,发现肥大细胞主要分布在皮肤、胸腹腔和脂肪组织中。利用基因诱导命运-示踪系统证实了胚胎期卵黄囊造血产生的早期(E7.5)EMPs和晚期 (E8.5)EMPs以及E9.5(AGM)区产生的造血干细胞(E9.5 HSCs)相继分化为肥大细胞前体细胞(integrin b7+),该前体迁移定居于外周组织,在E16.5分化成熟为富含颗粒的肥大细胞。不同起源的肥大细胞在新生期小鼠中具有不同的组织分布特性:E7.5 EMPs来源的肥大细胞主要分布在皮肤、脂肪组织和胸腔中;E8.5 EMPs来源的肥大细胞广泛分布在各结缔组织中,E9.5 EMPs来源的肥大细胞主要分布在肠道粘膜中。出生后,大部分结缔组织中(除了胸腔和脂肪组织外)E7.5 EMPs来源的肥大细胞逐渐被E8.5 EMPs来源的肥大细胞所取代。E8.5 EMPs 来源的肥大细胞长期定居在结缔组织中,具有自我更新和耐辐照的特性,因此成为成体结缔组织中肥大细胞库的主力军(见下图)。
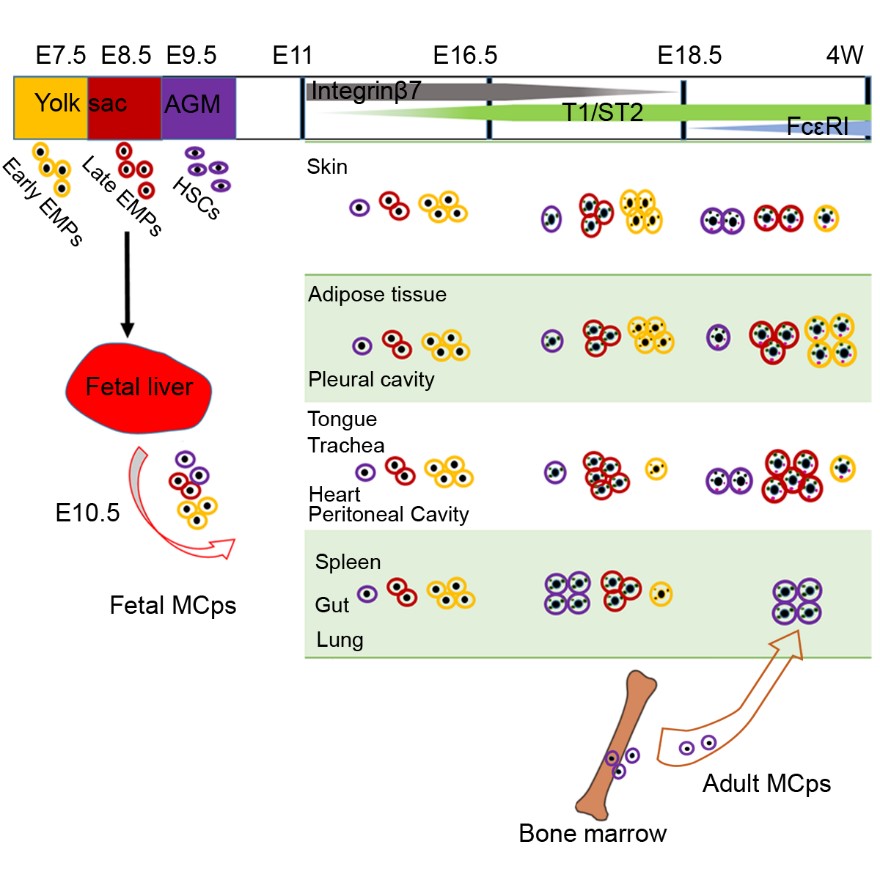
插图:肥大细胞的发育起源和分化路线
该研究明确了肥大细胞的起源,绘制了肥大细胞在胚胎期的分化路线,更新了人们关于肥大细胞分化起源的认识:正常成体小鼠的结缔组织肥大细胞主要起源于晚期E8.5 EMPs,在胚胎期就已发育完成并定居于结缔组织中,出生后在稳态条件下,它们一直保持自我更新,自我维持的特性,不依赖骨髓造血。只有当组织中肥大细胞因某种特定原因缺失时(如c-KitW/Wv小鼠),才促进了骨髓造血干细胞向肥大细胞的发育。此外该研究还发现,不同起源的肥大细胞在基因表达谱上具有差异,在脂肪组织和胸腔中同时存在E7.5 EMPs和E8.5 EMPs来源的肥大细胞,可见不同的起源赋予了肥大细胞异质性。

插图:博士生李志清与曹雪涛院士合影











