浙江大学基础医学院肿瘤中心董辰方教授课题组受到Cell旗下的肿瘤学期刊《Trends in Cancer》(JCR一区)总编Ana Batista邀请,在线发表题为“Gluconeogenesis in Cancer: Function and Regulation of PEPCK, FBPase, and G6Pase”的综述文章。该综述全方位探讨了糖异生代谢中三个关键酶-磷酸烯醇式丙酮酸羧激酶(PEPCK),果糖-1,6-二磷酸酶(FBPase)和葡糖-6-磷酸酶(G6Pase)在肿瘤代谢、增殖、信号通路以及肿瘤干性等方面取得的新成果,并展望了该领域未来发展方向。

即使在氧气充足的条件下,肿瘤细胞也主要以糖酵解方式促进肿瘤的发生发展,称为有氧糖酵解,即Warburg效应。Warburg效应是肿瘤的基本特征之一,靶向有氧糖酵解成为近年来备受关注的肿瘤研究热点。糖异生通路作为糖酵解的逆过程被认为在肿瘤中受到抑制以加强糖酵解,长期以来一直没有得到足够重视,然而越来越多的研究发现糖异生关键酶也拥有着强大的促肿瘤或抗肿瘤的功能。
PEPCK催化草酰乙酸形成磷酸烯醇式丙酮酸,这使其成为连接三羧酸循环和糖酵解的关键节点。任何进入三羧酸循环的代谢物都能经由PEPCK反流入糖酵解,进而促进了多条糖酵解代谢旁路,包括磷酸戊糖途径,丝氨酸、甘油和糖原合成 (Figure 1)。因此,高表达PEPCK的肿瘤细胞在葡萄糖缺乏的环境中能够利用乳酸、谷氨酰胺等非糖能源满足增殖需求。在肝癌和肾癌中,PEPCK却可以抑制肿瘤细胞生长,其原因在于肝、肾原本就是糖异生的主要器官并且表达所有糖异生关键酶,高表达PEPCK会促进整条糖异生通路从而生产大量葡萄糖,阻遏有氧糖酵解;而在肺癌、大肠癌中,高表达PEPCK却因为下游糖异生关键酶(FBPase和G6Pase)的缺失只能进行截断的糖异生通路,累积的糖异生中间产物会流入糖酵解代谢旁路中促进肿瘤细胞增殖。与PEPCK类似,G6Pase在非糖异生组织来源的肿瘤中高表达并起到促癌作用,而在肝、肾等糖异生组织来源肿瘤中低表达则发挥抑癌作用。董辰方教授此前的研究发现FBPase表达减少能够促进肿瘤细胞发生Warburg效应,并通过减少ROS维持肿瘤干细胞活性。然而,在低氧条件下,FBPase则发挥非酶功能,通过与HIF-1α直接结合进入细胞核抑制HIF-1α介导的有氧糖酵解相关酶的表达,从而抑制肿瘤生长与转移。
本综述结合董教授此前研究,系统阐述了糖异生代谢的三个关键酶在肿瘤中的功能多样性和调控机制,并对后续肿瘤糖异生代谢研究提出了独到的见解。深入研究糖异生代谢将为肿瘤治疗提供重要科学依据和潜在靶点。
该综述第一作者是医学院2015级本科生王占宇,通讯作者为董辰方教授。该成果受国家重点研发计划,国家自然科学基金项目,浙江省自然科学基金重点项目的资助。
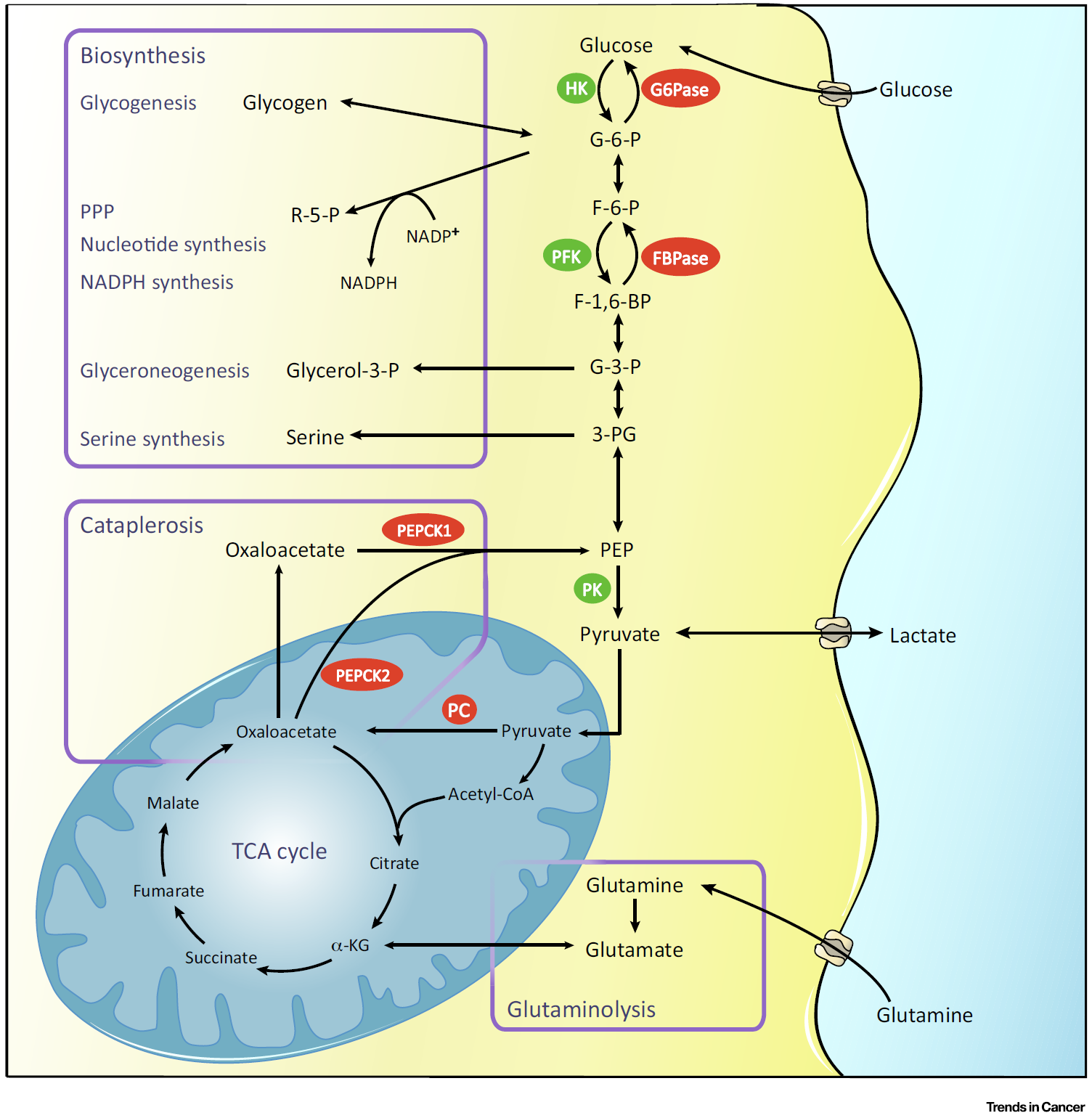
Figure 1. Gluconeogenesis and Its Branched Metabolic Pathways