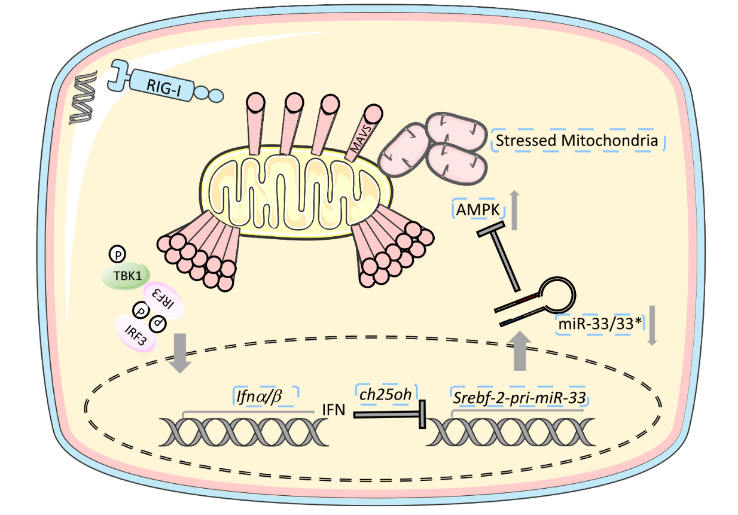
巨噬细胞受到RNA病毒感染后,可通过干扰素信号下调自身miR-33/33*的表达,以降低其对线粒体损伤清除过程的抑制,维持MAVS的活化及机体抗病毒信号的稳定
机体免疫细胞有效识别病毒入侵并及时触发抗病毒应答对于抵抗病毒感染至关重要。巨噬细胞介导的天然抗病毒应答主要通过模式识别受体(PRRs)对病毒核酸的识别来实现,其中RIG-I样受体(RLRs)主要参与胞质短链RNA的识别。RIG-I可识别并结合病毒的5’-pppRNA,并活化线粒体接头蛋白MAVS,激活下游信号,最终激活转录因子IRF3/7和NF-κB,促进干扰素和炎症因子的转录,发挥抗病毒作用。miR-33/33*是胆固醇调节的关键分子,在细胞能量代谢中发挥重要作用。课题组之前的研究发现miR-33可通过调节细胞膜脂筏含量,促进TLR诱导的巨噬细胞炎症应答,且其表达受TRIF信号调控,然而miR-33在巨噬细胞抗病毒免疫中的功能尚不明确。
在本研究中,课题组发现VSV感染巨噬细胞可通过IFNAR信号引起miR-33/33*表达下调。体内、体外实验均表明,过表达miR-33/33*可削弱RIG-I信号转导,抑制干扰素产生。通过对RIG-I活化过程的检测及对miR-33/33*靶点的筛选,发现miR-33/33*能靶向AMP活化蛋白激酶(AMPK)的mRNA并促进其降解,从而抑制RIG-I通路中线粒体接头蛋白MAVS激活,最终影响RIG-I信号的活化水平及干扰素的产生。机制方面,发现在抗病毒免疫过程中,MAVS活化需要线粒体处于高度融合-分裂的动态平衡,AMPK可通过介导线粒体自噬促进损伤线粒体的清除,从而维持线粒体稳态并为MAVS提供活化平台。而miR-33/33*对AMPK的靶向降解则干扰了其对损伤线粒体的清除与修复,进而破坏了线粒体稳定性,抑制了MAVS活化。综上所述,巨噬细胞受到RNA病毒感染后,可通过干扰素信号下调自身miR-33/33*的表达,以降低其对线粒体损伤清除过程的抑制,从而维持MAVS的活化及机体抗病毒信号的稳定。
论文的第一作者为免疫学系2015级直博生刘丹荟,其他合作作者包括本课题组薛越博士、宋寅敬博士等,药理学系来利华副教授、王青青教授为共同通讯作者。此项研究得到了国家自然科学基金、浙江省自然科学基金、中央高校基本科研专项资金的支持。
论文链接:https://www.nature.com/articles/s41423-019-0326-x