质子激活氯通道(Proton-activated chloride channel,PAC),是质子激活的外向整流的氯离子通道,广泛分布于各种细胞和组织。PAC通道参与胞外质子的感知、内体酸化和酸诱导的细胞死亡等过程,但PAC通道分布的广泛性提示其在生理病理过程可能具有重要功能。目前报道的PAC通道的调节剂如PIP2, DIDS均为广谱的离子通道调节剂,不适合用于研究PAC通道的生理病理功能,因而亟需发现特异性靶向PAC通道的新型调控分子。
近日,浙江大学基础医学院生物物理系/良渚实验室/附属第一医院的杨帆团队联合浙江大学医学院附属第四医院/“一带一路”国际医学院/国际健康研究院苏楠楠研究员团队、浙江大学转化医学研究院吕志民教授团队在Cell Reports杂志发表了题为"Discovery and Structural Basis of Endogenous and Exogenous Inhibitors of the Proton-activated-chloride Channel"的研究长文。该研究通过单颗粒冷冻电镜,直接看到胆固醇和以脱氧胆酸DCA为代表的胆汁酸分子是PAC通道的内源性抑制剂;通过大规模虚拟筛选,发现以伊文思蓝(Evans blue, EB)为代表的一系列染料分子是PAC通道的外源性、特异性抑制剂。

研究人员使用冷冻电镜观察PAC通道时,意外发现在PAC通道跨膜区存在类似胆固醇的电子云密度。在纯化过程中加入甲基-β-环糊精(MβCD)去除细胞膜上的胆固醇后,此电子云密度消失,提示内源性的胆固醇分子可能结合在PAC通道跨膜区。经膜片钳电生理记录确认,胆固醇作为部分抑制剂,可以剂量依赖地抑制PAC通道电流,将胆固醇电子云密度周围的关键位点突变后显著影响胆固醇活性,表明跨膜区类似胆固醇的电子云密度确实是胆固醇分子。
胆固醇只能部分抑制PAC通道,研究者猜想胆固醇的衍生物也可能调控PAC通道活性。实验结果显示,部分游离胆汁酸(BAs)对PAC有显著抑制作用,在这些胆汁酸中,脱氧胆酸DCA表现出最好的抑制活性,IC50为12.89 ± 0.41 μM。研究者进一步通过冷冻电镜解析了DCA与PAC通道的复合物结构(hPACDCA),结合分子动力学模拟和电生理记录,研究者发现DCA与胆固醇的结合方式类似,将跨膜区疏水性氨基酸突变后,DCA活性受到显著影响,说明DCA通过疏水作用结合于PAC通道跨膜区,通过将通道稳定在关闭态构象发挥抑制作用。然而,胆固醇及其结构类似物也能够调节其他离子通道和受体的活性,由于缺乏特异性,它们不适合用作研究PAC通道药理学的工具化合物。
随着冷冻电子显微镜(cryo-EM)的革命性发展和蛋白高分辨率三维结构的不断解析,基于靶点蛋白质结构的大规模虚拟筛选成为开发高特异性调节剂的重要策略。因此,研究者以PAC通道的孔区为靶标结构域,将Zinc化合物库和real compound化合物库中的800万个化合物对接到PAC通道的孔区,然后通过评分函数评估化合物的亲和力,选择亲和力高于-10 kcal/mol的化合物作为候选化合物进行后续活性评价。筛选发现台盼蓝(Trypan blue,TB)有明显的抑制活性,IC50为8.28 ± 1.98 μM。研究者进一步测试了与TB结构相关的染料对PAC通道的抑制活性,在这些染料中,伊文思蓝(Evans blue,EB)对PAC电流的抑制作用最强,其IC50值为0.62 ± 0.05 μM,比TB的抑制效果提高了十倍以上。而且,EB对TMEM16A和ClC-2氯通道无抑制效果,也几乎无法抑制TRP通道的电流,说明EB是高特异的PAC抑制剂。
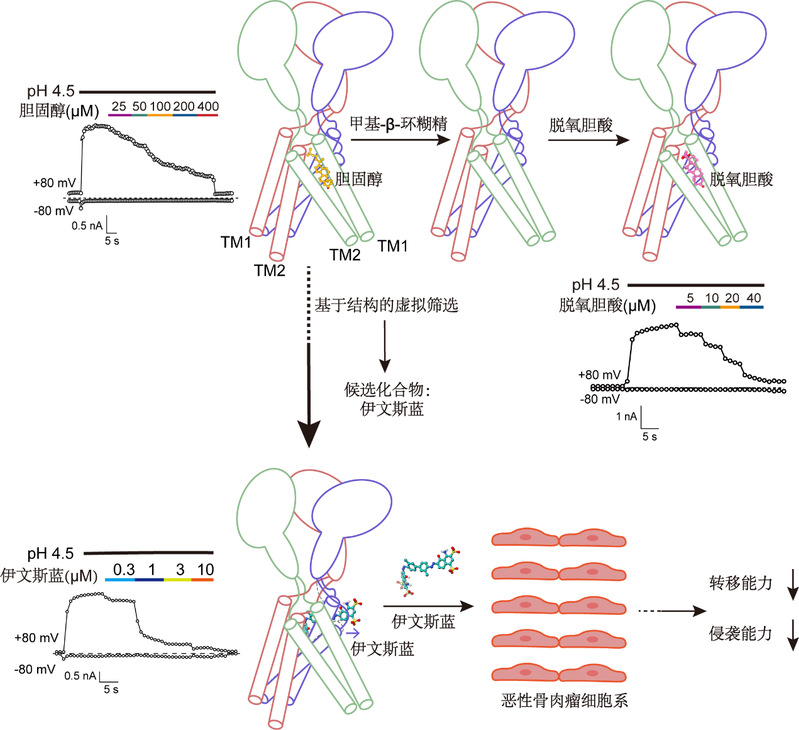
为确定EB结合并抑制PAC通道的分子机制,研究者通过冷冻电镜解析了PAC通道与EB的复合物结构(hPACEB),与胆固醇、DCA的结合口袋不同,研究者在hPACEB的孔区观察到1个额外的较大电子云密度,且在500 ns的分子动力学模拟时间内,EB可以稳定结合于孔区入口,提示EB可能是PAC的孔区阻滞剂。点突变结果进一步确认EB的结合口袋位于孔区:孔区的双点突变R87A-N302D使EB抑制的浓度效应曲线显著右移,继续将L309A引入到R87A-N302D后,EB变为三突变通道的部分抑制剂。此外,R87A-N302D改变了通道的外向整流特性:在质子存在时,R87A-N302D双突变通道在去极化电压和超极化电压下均有明显电流,而EB对R87A-N302D双突变的抑制呈现出明显的电压依赖性,进一步支持了EB作为孔区阻滞剂的抑制机制。
在转化应用上,PAC通道的表达在恶性骨肉瘤中上调,其高表达水平与恶性骨肉瘤患者的临床分期进展及肺转移密切相关。因此研究者以EB为工具化合物,探索PAC敲低或EB处理对恶性骨肉瘤细胞系(MG-63和U2OS)的侵袭和转移能力的影响。划痕实验和Transwell实验结果显示,PAC敲低的MG-63和U2OS细胞的侵袭和转移能力显著下降,而EB处理后的MG-63和U2OS细胞的侵袭和转移能力表现出浓度依赖地下降,说明EB可以通过抑制PAC通道的活性而减弱恶性骨肉瘤细胞的侵袭和转移能力。
浙江大学良渚实验室博士后张恒博士、博士研究生赵志君、浙江大学良渚实验室博士后陈晓莹博士和青岛大学肿瘤研究院特聘副教授马清霞博士为该工作的共同第一作者。杨帆长聘副教授、苏楠楠研究员、吕志民教授和陈晓莹博士为本文的共同通讯作者。徐浩新教授和徐鹏飞教授为本研究提供了宝贵的意见和大力支持。本研究得到了国家自然基金委、浙江省自然基金委和中国博士后科学基金的资助,浙江大学冷冻电镜中心为本研究提供了冷冻电镜支持,本研究也得到了冷冻电镜中心常圣海博士、武灵云老师和医学院蛋白质平台马骋博士的支持。
原文链接:10.1016/j.celrep.2025.115998








