焦虑障碍与攻击行为的共病现象在临床中极为常见,这类患者往往面临更严重的功能损害和更差的预后。然而,由于缺乏能够模拟人类心理压力下共病特征的动物模型,其背后的神经机制长期不明。传统模型(如社会挫败应激)多聚焦单一行为,且依赖物理接触,难以真实反映人类因长期心理威胁引发的复杂行为变化。
2025年5月21日,浙江大学基础医学院连虹、浙江大学医学院李晓明课题组,在National Science Review发表了题为:Medial preoptic CCKAR mediates anxiety and aggression induced by chronic emotional stress in male mice的研究论文,首次揭示下丘脑内侧视前区(mPOA)参与调控慢性情绪压力引发焦虑与攻击行为共病的神经机制。
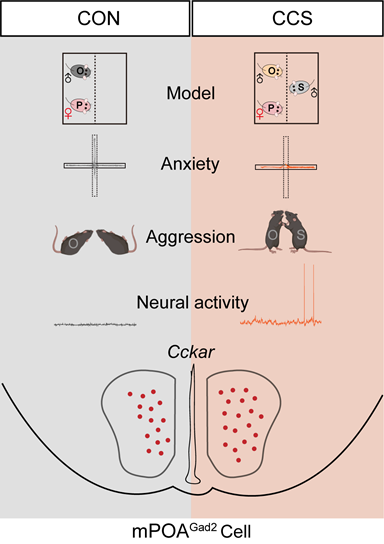
全新动物模型:慢性同类外来压力(CCS)”模型
研究团队独辟蹊径,设计出全新的CCS动物模型:将雄性小鼠与雌性伴侣共同饲养,并在透明隔板另一侧持续引入竞争性雄性“外来者”。通过7天压力暴露,雄性小鼠不仅表现出显著的焦虑样行为(如减少光照区探索),还出现对“外来者”的攻击倾向,同时伴随社交识别能力下降。重要的是,这一模型成功模拟了人类因长期心理压力引发的行为特征,且具有性别特异性(仅雄性敏感),为深入研究共病机制提供了理想工具。
锁定关键脑区:mPOA GABA能神经元的双向调控
通过Fos活性图谱分析,研究团队发现CCS小鼠的mPOA脑区GABA能神经元(而非谷氨酸能神经元)活性显著升高。进一步的电生理实验显示,这些神经元的静息膜电位去极化、激活阈值降低,呈现“超兴奋”状态。为验证其功能,团队采用化学遗传学技术精准操控神经元活动:抑制mPOA GABA能神经元:显著缓解CCS小鼠的焦虑与攻击行为,并恢复其社交识别能力;激活该神经元:即使仅给予3天阈下压力,也能诱导出与CCS模型相似的行为异常。这一双向调控效应表明,mPOA GABA能神经元是焦虑与攻击共现的“神经开关”。
分子揭秘:CCKAR——焦虑与攻击的“分子枢纽”
研究进一步锁定关键分子CCKAR。Western blot和RNA原位杂交显示,CCS小鼠mPOA中CCKAR的mRNA和蛋白表达显著上调,且72%的CCKAR阳性细胞为GABA能神经元。通过基因编辑与药理学干预,团队证实:敲低CCKAR:可逆转CCS小鼠的行为异常,降低神经元兴奋性;过表达CCKAR:即便在低压力条件下,也能诱发焦虑与攻击行为;药物干预:mPOA局部注射CCKAR拮抗剂MK-329可缓解症状,而激动剂A71623则加剧行为异常。这些结果首次揭示CCKAR通过调控GABA能神经元兴奋性,直接驱动焦虑与攻击的共现,为靶向治疗提供了明确分子靶点。
综上所述,该研究通过创新性构建的“慢性同类外来压力(CCS)”小鼠模型,发现内侧视前区(mPOA)的GABA能神经元及其关键分子胆囊收缩素A型受体(CCKAR)是调控这两种行为共现的核心靶点,这一发现为焦虑障碍伴攻击行为的治疗提供了全新方向。
浙江大学脑科学与脑医学学院唐梦宇、张妍祎、林琳为论文共同第一作者,浙江大学基础医学院连虹副教授为论文通讯作者,李晓明教授为共同通讯作者。该研究得到国家自然科学基金、科技创新2030重大项目等支持。










