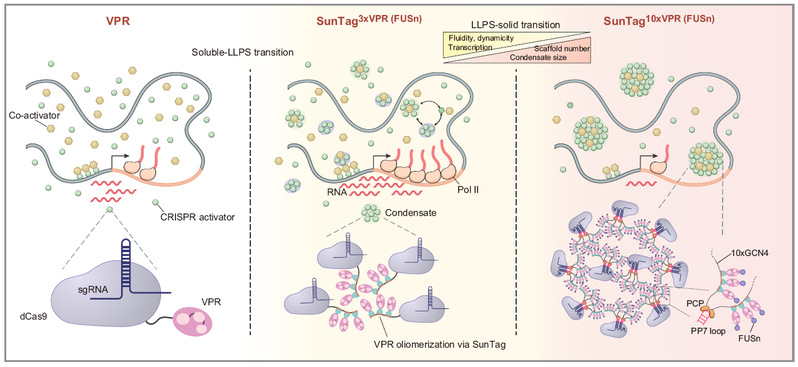
CRISPRa (CRISPR activation)技术是一种基因激活方法,其基本原理是把无核酸酶活性Cas9(dCas9)与不同的转录激活因子(通常是转录因子的激活结构域)融合,在sgRNA的引导下结合到目标基因的转录起始位点附近,从而促进转录。该技术在基因功能研究、疾病模型构建和基因治疗等领域具有广泛的应用前景。研究人员已经开发了多个版本的CRISPRa技术,其优化升级思路在于如何让CRISPRa系统尽可能多地招募转录激活因子,提高转录因子在转录中心处的浓度,实现类似于超级增强子的工作原理。近期的研究表明,转录因子可通过相分离(Liquid-Liquid Phase Separation, LLPS)形成凝聚体,但凝聚体的形成如何影响基因激活仍存在争议。由于在活细胞中很难精确证明转录因子凝聚体在特定基因位置形成并直接调控转录,如何评估凝聚体在转录调控中的重要性仍然是一个技术难题。
2025年2月14日,浙江大学医学院陈宝惠研究员与邹炜研究员、刘楠研究员团队合作在《Nature Communications》发表题为“Dynamic properties of transcriptional condensates mediate CRISPRa-mediated gene activation”的研究论文。本研究出乎意料地发现不同于优化CRISPRa的传统思路,CRISPRa系统中转录因子招募过多可能反而导致CRISPRa失去基因激活能力。作者通过活细胞示踪系统可视化CRISPRa分子的行为,发现CRISPRa系统的不同构建策略会导致CRISPRa复合物形成物理性质不同的转录凝聚体,而转录凝聚体的动态特性是其激活基因效率的关键影响因素。

研究团队利用SunTag的支架作用让CRISPRa系统招募不同拷贝数的转录因子,例如包含3或10个串联VPR基因激活结构域的3xVPR和10xVPR系统,从而构建了多种CRISPRa系统。作者通过活细胞示踪系统,发现3xVPR系统能够形成高流动性液态凝聚体,显著延长目标基因的转录爆发时间并增强mRNA合成强度,激活效率显著高于第一代和第二代CRISPRa系统(例如VP64、VPR)。当SunTag支架增至10个时(10xVPR系统),凝聚体从液态转向固态,流动性降低,共激活因子(如p300和MED1等)被“滞留”在凝聚体内,导致核质中游离的共激活因子减少,基因激活效率骤降。
作者利用团队前期开发的活细胞转录示踪方法,实现转录爆发与CRISPRa凝聚体动态的同步观测。通过单细胞实时成像和定量发现,转录中心有CRISPRa凝聚体出现的时候,新生RNA产生显著变多。基因激活强度与凝聚体的动态性、流动性高度相关,而与相分离强度的总体水平并没有关联。作者进一步改变CRISPRa设计,除了调节SunTag支架数量,还增加或替换CRISPRa复合物中的IDR结构域(如FUS、NUP98和SMN1),发现不同IDR的使用会导致CRISPRa分子呈现动态及流动性不同的凝聚体,只有具备高流动性的特征才能有效激活基因。
CRISPRa分子形成凝聚体的动态特征影响基因激活效率
基于上述研究,作者提出:合适的相分离水平(形成流动性和动态性高的凝聚体)反映CRISPRa系统中具有合适的多价相互作用,其通过与周围分子的动态相互作用,能够有效地将转录因子和共激活因子集中在转录起始位点附近,创造有利于激活转录的微环境,从而促进高效的基因转录激活。基于相分离的CRISPRa平台(简称DropCRISPRa)代表了新一代CRISPRa工具。该研究不仅揭示了转录凝聚体的动态特性在基因调控中的核心作用,更为开发下一代可编程合成凝聚体提供了重要参考。未来,研究人员可通过精准设计多价相互作用的分子网络实现基因表达的高效、可控调节。
浙江大学基础医学院/良渚实验室扶玉娟博士、浙江大学基础医学院博士生杨小萱、硕士生李思卉(已毕业)为本文的共同第一作者。浙江大学基础医学院陈宝惠研究员、浙江大学转化医学研究院邹炜研究员和良渚实验室刘楠研究员为本文通讯作者。浙江大学医学院梁洪青研究员、徐鹏飞研究员、尹亚飞研究员和贵州师范大学生科院王晓月副教授参与了本研究工作。感谢西湖大学杨培国研究员、上海交大徐恒研究员和浙江大学生命科学研究院陆华松研究员对本课题的大力帮助。本研究受到国家自然科学基金和科技部重点研发计划的支持。










