丙酮酸脱氢酶复合物(Pyruvate Dehydrogenase Complex, PDHc)是细胞氧化代谢和能量代谢中的关键多酶复合体。它催化丙酮酸脱羧生成乙酰辅酶A(Acetyl-CoA),进一步进入三羧酸循环(TCA),同时连接脂肪酸和类固醇的生物合成。PDHc反应产物NADH和乙酰辅酶A在电子传递链、氧化还原平衡、脂质和神经递质合成、ATP生成以及蛋白质和组蛋白乙酰化等多个关键生理过程中发挥着重要作用。由于其在代谢网络中的中心地位,PDHc的功能异常与多种疾病密切相关,如神经退行性疾病、代谢性酸中毒、糖尿病和癌症等。
尽管PDHc所有亚基的单独结构已被解析,但由于其巨大的分子量(真核生物超过1000万道尔顿)、高度柔性和结构异质性,数十年来,完整原位PDHc的三维结构仍未被解析,限制了我们对其功能状态下具体组成、装配机制及催化过程中脂酰结构域(Lipoyl Domain, LD)传递底物分子机制的理解,进而影响了相关疾病治疗策略的制定。
2025年1月22日,浙江大学医学院/附属邵逸夫医院/冷冻电镜中心张兴教授与常云杰特聘研究员团队联合浙江大学生命科学学院高海春教授团队在Nature Communications发表题为“Dynamics of the mammalian pyruvate dehydrogenase complex revealed by in-situ structural analysis”的研究论文。本研究利用冷冻电子断层扫描技术(Cryo-Electron Tomography, Cryo-ET),首次揭示了哺乳动物完整PDHc的原位三维结构,详细分析了外周亚基E1和E3的数量与空间排布,提供了PDHc高度异质性的直接结构证据,并深入探讨了各亚基之间的协同工作机制。此外,研究还阐明了PDHc催化过程中脂酰结构域(LD)在E1和E2之间动态传递底物的分子机制,为靶向PDHc的药物设计奠定了坚实的结构基础,也为多酶复合体催化机制研究提供了新的思路。
主要发现与研究亮点
1.原位PDHc外周亚基数量与排布的动态性
在原位环境中,PDHc的E1和E3亚基数量呈动态变化。最多可观察到46个E1异源四聚体和12个E3二聚体,平均每个PDHc含有21个E1异源四聚体和4个E3二聚体。E1和E3的数量呈现出每5个E1对应1个E3的线性关系,揭示了PDHc在功能状态下亚基组装的规律。空间分布上,E1主要分布在二十面体核心的2次、3次和5次对称轴,而E3主要集中于5次对称轴,反映了PDHc独特的装配机制。
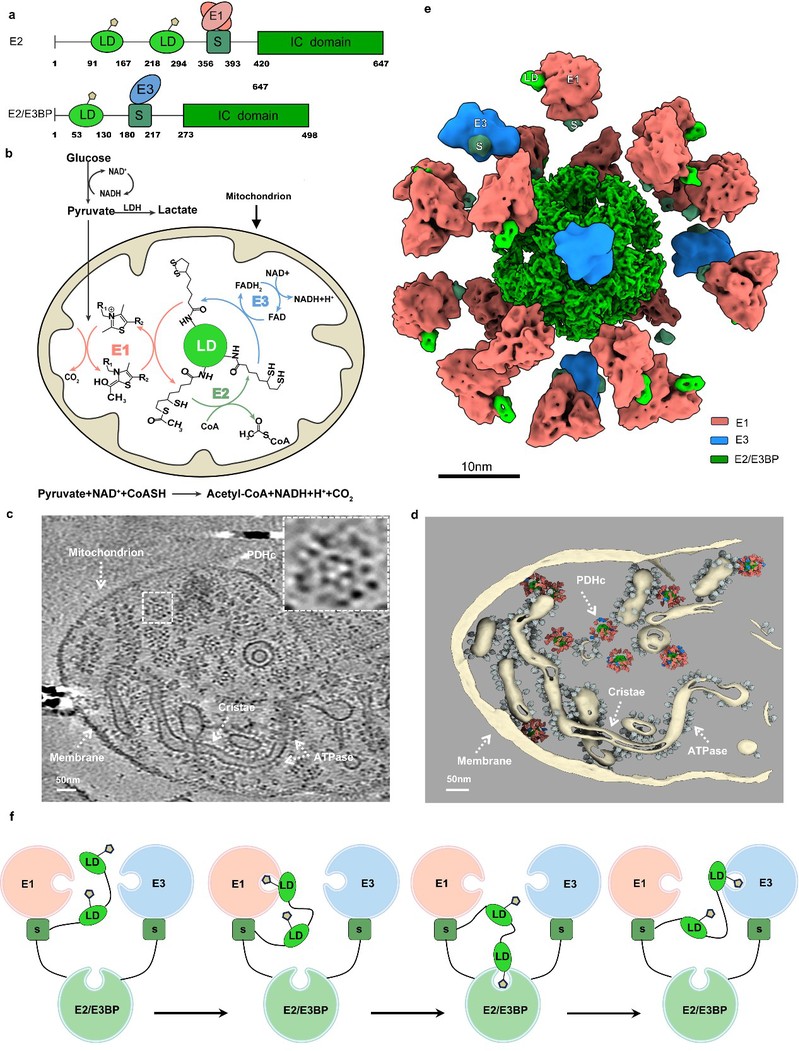
图1. 哺乳动物线粒体PDHc的原位结构。
2.高分辨率核心结构与动态交互界面
研究获得了4.3 Å分辨率的PDHc核心结构,明确观察到核心N端的连接子(Linker)、脂酰结构域(LD)和外周亚基结合域(PSBD)的密度信息。捕捉到LD与E1和E2之间的动态相互作用,并结合单颗粒结构解析和分子动力学模拟深入分析了相互作用界面。结果显示,静电相互作用和疏水相互作用在稳定LD与酶活性亚基的结合界面中发挥关键作用。
3.提出了新型的PDHc原位催化调控模型
基于原位结构及外周亚基动态变化,研究者提出了新型的PDHc催化循环机制:在生理条件下,PDHc中的E1、E3和功能性LD的数量可动态协调,以适应不断变化的细胞代谢需求,实现高效灵活的能量转换。

图2. PDHc的动态催化调控模型。
研究意义与前景
本研究为深入理解PDHc在代谢调控中的动态催化机制提供了直接的结构证据,揭示了PDHc在不同代谢状态下的灵活性调节机制。这不仅为线粒体相关疾病(如糖尿病、癌症、神经退行性疾病)的靶向药物设计提供了理论依据和技术指导,也为α-酮酸脱氢酶复合体家族(OADHc)其他成员的结构和功能研究提供了重要参考。
作者信息
浙江大学医学院附属邵逸夫医院病理科王晨博士、浙江大学蛋白质平台马骋博士、浙江大学生命科学学院徐源佑博士研究生为本文共同第一作者。浙江大学医学院/附属邵逸夫医院/冷冻电镜中心常云杰特聘研究员、张兴教授、浙江大学生命科学学院高海春教授为本文通讯作者。
张兴教授团队长期致力于基于冷冻电镜对超大复合物分子的结构解析与功能研究。常云杰特聘研究员长期从事电子显微学相关的方法开发和应用工作,主要研究方向为基于冷冻电镜断层扫描技术的动态蛋白复合物原位高分辨结构和功能解析。如需进一步了解本研究内容,欢迎联系相关作者。








