细胞自噬为维持细胞稳态所必需。根据其降解底物的选择性不同,可以将自噬分为非选择性自噬和选择性自噬。非选择性自噬降解的底物相对而言没有选择性,如雷帕霉素处理诱导的自噬、氮源饥饿诱导的自噬、血清饥饿诱导的自噬等。选择性自噬则是指由选择性自噬受体通过与LC3(在酵母和植物细胞中为Atg8)直接结合将特定的降解底物定向运送到自噬体中进行降解。
目前发现的选择性自噬类型有线粒体自噬、核糖体自噬、内质网自噬、过氧化物酶体自噬等。越来越多的研究表明,选择性自噬发生异常与人类许多重大疾病的发生发展如神经退行性疾病、代谢性疾病等密切相关。因此,研究选择性自噬发生的分子机制能够为相关药物的开发和疾病的治疗提供靶点和理论依据。
Atg11作为支架蛋白(scaffold protein),在选择性自噬发生过程中发挥重要作用。Atg11蛋白首先是由美国密歇根大学Janiel klionsky教授实验室发现。他们在研究Cvt通路(Cytoplasm to vacuole targeting pathway)时,发现Atg11敲除能够抑制Cvt通路发生。Atg11是一个多功能蛋白,具有四个结构域,分别为CC1、CC2、CC3和CC4。Atg11一方面通过CC4结构域与底物受体结合,另一方面通过CC2和CC3结构域与自噬核心蛋白Atg1(一种自噬发生必需的蛋白激酶)结合,从而将底物招募到自噬体中进行包裹。
随着研究的深入,研究人员发现Atg11在其它类型的选择性自噬如线粒体自噬、过氧化酶体自噬和内质网自噬等的发生过程中也起关键作用。因此,Atg11被当成是选择性自噬发生的标记蛋白。然而,到目前为止,Atg11自身活性的调控研究却非常少。
2022年4月15日,浙江大学基础医学院易聪课题组在自噬专业期刊Autophagy上在线发表题为“Atg1-mediated Atg11 phosphorylation is required for selective autophagy by regulating its association with receptor proteins”的研究论文,发现了Atg11调控选择性自噬发生的新机制。
在此项研究中,研究人员发现细胞在受到雷帕霉素处理、氮源饥饿或葡萄糖饥饿时,Atg11蛋白的位置较之于正常培养条件下的位置有一个明显的向上移动。磷酸酶PPase处理该蛋白样品,发现Atg11蛋白的向上移动消失,证实Atg11在自噬发生过程中发生了磷酸化修饰。
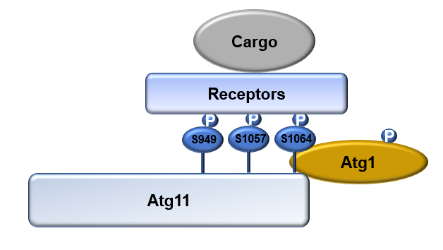
紧接着,研究人员发现Atg11是蛋白激酶Atg1的直接作用底物。通过体外磷酸化实验发现,与受体蛋白结合的Atg11 CC4结构域正是Atg1磷酸化Atg11的区域,暗示着Atg1极有可能通过磷酸化Atg11来调控其与选择性自噬受体的结合。为了鉴定其磷酸化位点,体外磷酸化实验得到的Atg11 CC4蛋白被质谱分析,鉴定到S949, S1057, 和 S1064是Atg1磷酸化Atg11的磷酸化位点。进一步的功能分析实验表明这三个位点的突变通过抑制其与选择性自噬受体的结合,来影响选择性自噬的发生(图1)。
图1 Atg1磷酸化Atg11调控选择性自噬发生的模式图综上所述, Atg11通过磷酸化调节其与选择性自噬受体的结合来调控选择性自噬的发生。该研究工作从一个新的层面阐明了选择性自噬发生的调控机制。正如其中一个审稿人所说“I find this study reveals a new layer of regulation in selective autophagy”。
浙江大学基础医学院易聪研究员为本文的通讯作者,其课题组成员姚伟静,李宜醒(已毕业),陈颖聪和陈禹亭为本文的共同第一作者。易聪课题组访问学者谢妤,转化院博士生张颖,临床专业本科生吴小勇、冯雨瑶,浙江理工大学硕士生叶淼娟为本课题的完成做出了重要贡献。该课题的开展还得到生化系刘伟教授,海宁国际校区洪智教授,转化院陈祥军教授以及浙江理工大学王毅刚教授的大力支持。此研究得到了国家基金委、科技部、浙江省自然科学基金委杰出青年基金等经费的资助。
课题组简介
易聪研究员课题组主要研究方向:
1. 细胞选择性自噬发生的分子机理及其生理病理意义
2. 能量代谢与细胞稳态之间的内在关联
本课题组目前正在积极招聘博士后研究人员、科研助理,欢迎热爱科研的你加入!
教师个人主页:https://person.zju.edu.cn/yclab