2022年3月31日,浙江大学基础医学院周龙团队与美国加州大学戴维斯分校James Letts团队合作在Science期刊以Research Article的形式在线发表了题为“Structures of Tetrahymena ’s respiratory chain reveal the diversity of eukaryotic core metabolism”的研究论文,解析了纤毛纲重要模式生物嗜热四膜虫(Tetrahymena thermophila, Tt)线粒体的氧化磷酸化电子传递链(electron transport chain, ETC)超复合体I-III2(SC I+III2)及复合体IV二聚体(CIV2)分别2.6Å与3.0Å的冷冻电镜结构。

嗜热四膜虫SC I+III2分子量达到2.3 MDa,由91个亚基组成;相比较下哺乳类SC I+III2分子量仅1.4 MDa,67个亚基。四膜虫复合体I核心亚基分裂成17个,打破了哺乳类14核心亚基的布局;其51个附属亚基中有20个为本研究首次发现。
值得注意的是,与哺乳类不同,四膜虫复合体I并不存在“激活-失活”两种状态,结构上也没有膜内外两臂夹角改变导致的“开放-闭合”两种构象。对于这种持续激活的复合体I,其CoQ通道附近对底物回转有重要意义的几个环区(ND3 TMH 1-2等)均与 “闭合”态的哺乳类复合体I一致。
这提示“开放-闭合” 的构象转变或许并非真核复合体I普遍保守催化机制的一部分,也为长期激烈争论的复合体I工作机理的研究提供了新思路。
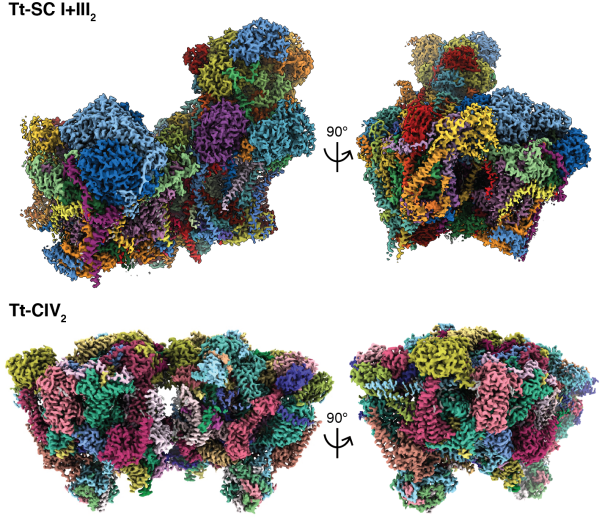
四膜虫SC I+III2的复合体I与复合体III2融合为一个“强制超复合体”,膜内部分整体适应四膜虫存在平滑弧度的嵴形态。值得注意的是,二者间的紧密结合导致复合体III2两个单体间发生对称性破坏,程度在现有各物种SC I+III2结构中最为显著。这导致在复合体III2的“醌循环”机制中,仅靠近复合体I醌通道的单体具备CoQ氧化还原能力;提示高度保守的超复合体SC I+III2形成的生理意义,在于通过分化复合体III2两个“醌口袋”的氧化与还原功能来调控复合体I与III2间反应速率的耦合。
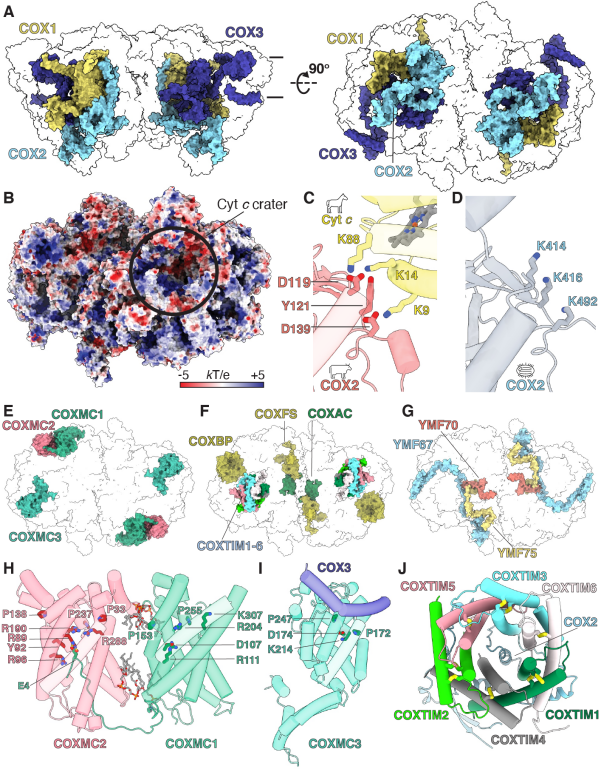
四膜虫ETC复合体的高度特异性集中体现在其复合体IV强制二聚体CIV2上,其分子量达到2.7 MDa,每单体由52个亚基组成,其中44个亚基为本研究首次发现。这远超10-14亚基,约200 kDa的酵母、植物与哺乳类复合体IV单体,同时也超过四膜虫自身的SC I+III2成为其最大ETC复合体,打破了复合体I是ETC中最大膜蛋白的传统认知。
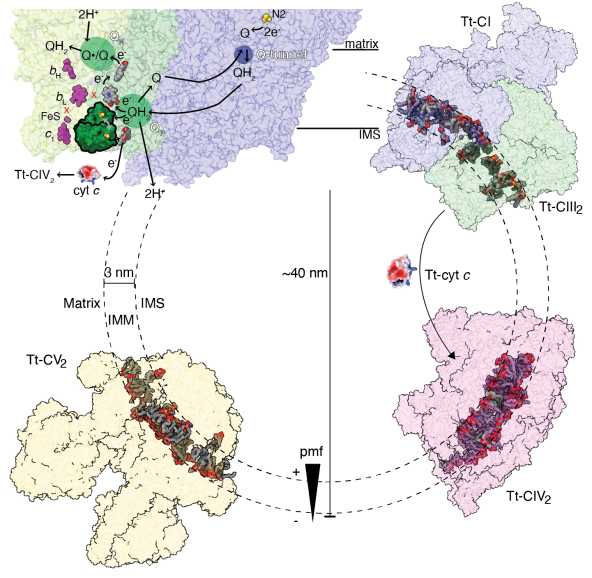
四膜虫CIV2的细胞色素c结合位点特化为一个“深坑”且相较于哺乳类发生表面电势的正负反转,揭示了长期困扰本领域的纤毛纲与哺乳类物种间无法完成电子传递的原因。在其大量附属亚基中,存在三个SLC25A家族线粒体转运蛋白,经序列与结构比对可基本确定其中至少一个为a-酮戊二酸转运蛋白SLC25A11。
同时,其细胞色素c“深坑”附近结合了一个来自线粒体内外膜转运系统(Translocase of the inner/outer membrane, TIM/TOM)的,类似六聚TIM8/9/10/12分子伴侣的a-螺旋桨结构。这些在线粒体中意义重大的蛋白首次被发现与氧化磷酸化复合体相结合,提示四膜虫CIV2已将电子传递功能与膜电势耦合转运或氧化还原稳态调控等整合在一起。
这项研究的特色在于,从一个经典模式生物入手,在结构、功能、调控等多个层面密集地打破了ETC复合体的现有范式,为领域研究注入了新的活力。
同时,本研究使用了从一套单颗粒数据中同时解析几个复合体结构,以及完全依靠电子密度与蛋白质组从头建模等前沿冷冻电镜技术。一位匿名评审专家在审稿意见中说:“对我而言,阅读这份稿件确实是一次瞠目结舌的体验(Reading the manuscript for me was truly a jaw-dropping experience)”。
James Letts博士是本文的通讯作者,浙江大学基础医学院周龙博士与UCD María Maldonado博士是本文共同第一作者,参与合作的还有Abhilash Padavannil博士与UCD电镜平台主任郭飞博士。
周龙博士,现任浙江大学基础医学院生物物理系百人计划研究员,课题组致力于氧化磷酸化复合体结构多样性,精细工作机制及其他线粒体相关重要分子机器研究工作,主要研究成果发表于Science,Blood,NSMB,elife等期刊。
现面向海内外公开招聘博士后研究人员1-2名,感兴趣者请将个人简历发送至longzhou@zju.edu.cn并注明“姓名+博士后应聘”。










