肿瘤细胞与微环境细胞间的相互作用对于肿瘤转移至关重要。目前,人们对旁分泌信号介导的微环境细胞间互作促进肿瘤转移,已有了深入了解。如在胃癌进展过程中,多种细胞因子、生长因子和细胞外基质蛋白通过异常旁分泌信号促进肿瘤细胞的进展转移。
但临床上,我们很早就注意到一个现象,患者的肿瘤组织,无论是实体原发灶还是转移灶组织,很多肿瘤细胞与基质细胞是直接紧密接触的,特别是那些侵袭前沿的肿瘤细胞。那么,肿瘤细胞与相邻基质细胞间这种直接紧密接触的近分泌信号(Juxtacrine),在胃癌进展转移中发挥什么作用?
近日,浙江大学基础医学院卓巍/周天华教授课题组,在《Science Bulletin》在线发表题为“Cadherin 11-mediated juxtacrine interaction of gastric cancer cells and fibroblasts promotes metastasis via YAP/tenascin-C signaling”的研究论文,报道了Cadherin 11介导的胃癌细胞和成纤维细胞近分泌信号激活YAP/Tenascin-C轴促进胃癌转移的新机制。
钙黏蛋白(Cadherins)家族,是一类经典的介导细胞间Juxtacrine作用的跨膜糖蛋白,研究人员以Cadherins为研究Juxtacrine作用的切入点,利用TCGA数据库和多个胃癌样本验证队列,系统筛选Cadherins家族,发现Cadherin 11(CDH11)是唯一在胃癌组织中表达显著上调、与TNM分期相关、且和患者不良预后显著相关的黏附分子成员。
小鼠实验提示CDH11在胃癌细胞转移中发挥关键作用。研究人员分析CDH11与多种微环境细胞的关联情况,发现胃癌组织中CDH11表达水平与肿瘤相关成纤维细胞(cancer associated fibroblasts, CAFs)主要标志物紧密关联,提示CDH11可能参与了胃癌细胞与CAFs的相互作用。
随后,研究人员通过建立体外细胞-细胞粘附模型、共培养模型、及体内共转移模型等,验证了CDH11介导了胃癌细胞与成纤维细胞之间的粘附互作,促进胃癌细胞的迁移、肿瘤球形成以及体内转移等恶性行为。机制上,研究人员阐释了CDH11介导的胃癌细胞与成纤维细胞的直接互作,能激活胃癌细胞YAP信号通路,促进YAP入核,上调Tenascin-C (TNC) 转录表达。多种挽救验证方法验证了YAP通路及靶基因TNC,参与了CDH11介导的成纤维细胞促胃癌细胞迁移、肿瘤球形成等恶性表型。
最后,多个胃癌样本队列数据表明CDH11,YAP和TNC在胃癌中表达上调,三者之间的表达水平紧密关联,且与胃癌患者不良预后显著相关。
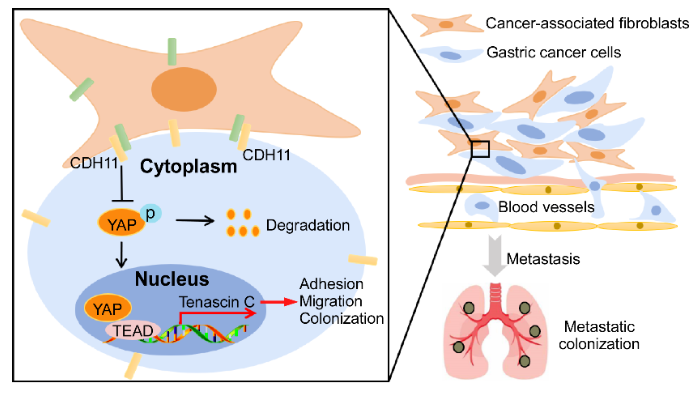
综上,该研究阐释了胃癌细胞与微环境成纤维细胞间这种“手拉手”方式的Juxtacrine作用在胃癌转移中的重要作用,研究揭示的CDH11-YAP-TNC近分泌信号轴有助于深入了解肿瘤微环境细胞间的通讯方式,为胃癌转移的临床治疗和预后提供了潜在的靶点。
浙江大学基础医学院卓巍教授和周天华教授,浙江大学医学院附属第二医院王良静教授,浙江大学医学院附属第一医院滕理送教授等为该论文的共同通讯作者,浙江大学医学院倪娇娇博士、姜明春硕士、陈艳妍博士和饶显平硕士等为该论文的共同第一作者。研究受国家自然科学基金、浙江省自然科学基金、中央高校基本科研专项资金的资助。










