饥饿素(Ghrelin)及饥饿素受体(Ghrelin Receptor)是人体肠脑轴中参与食欲调节和能量稳态的重要成分。饥饿素受体被饥饿素激活后,可调节促食神经肽的分泌,促进摄食行为。饥饿素受体具有较高的组成型活性(~50%),该特征在调控饥饿摄食等生理中起到重要的平衡作用。针对该受体的拮抗剂药物仅限于抑制饥饿素诱导的摄食行为,无法阻止饥饿素受体本底活性引起的摄食行为。
因此,饥饿素受体的反向激动剂药物的开发,抑制饥饿素受体本底活性,有助于抑制饥饿素-饥饿素受体信号轴,是预防肥胖和2型糖尿病(T2D)的一种有效的疗法。然而,目前饥饿素受体对其反向激动剂的识别方式及反向激动的分子机制尚不明确,阻碍了靶向药物的进一步研发。
2022年1月13日,浙江大学基础医学院/良渚实验室张岩课题组与四川大学华西医院邵振华课题组在Nature Communications发表了题为“Molecular mechanism of agonism and inverse agonism in ghrelin receptor”的研究论文, 该成果报道了人源饥饿素受体与反向激动剂PF-05190457结合的晶体结构,以及与内源性配体饥饿素激活受体后结合Go蛋白复合物的冷冻电镜结构,揭示了饥饿素受体识别不同类型配体的分子机制与构象变化,阐释了饥饿素受体激活与反向激动的分子机制。

饥饿素是一种具有特殊酰基化修饰的多肽激素,它是目前唯一已知的由胃肠道分泌的促食欲激素。研究团队采用单颗粒冷冻电镜技术,解析了饥饿素受体结合饥饿素与Go蛋白复合物的高分辨率结构(分辨率2.8 Å)。
结合功能实验分析,详细阐释了饥饿素受体与饥饿素结合的分子机制,发现饥饿素的辛酰基修饰基团位于I1784.60, L2105.36, F2866.58等疏水氨基酸组成的疏水空腔中,并确定了饥饿素受体中位于辛酰基基团内侧的E3.33-R6.55 motif 以及N3057.35等氨基酸残基组成的极性网络对饥饿素的特异性识别起到重要的作用(图1)。
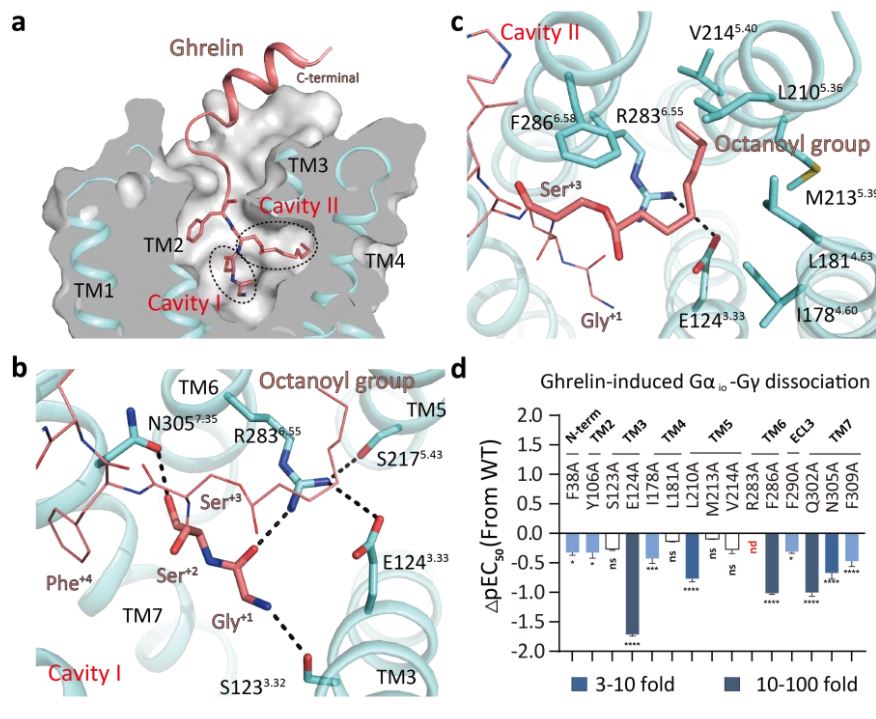
图1 饥饿素与饥饿素受体的结合方式
PF-05190457是目前唯一已开展II期临床试验的饥饿素受体反向激动剂,可用于口服治疗T2D和酗酒。作者们通过晶体结构分析与功能验证,揭示了PF-05190457与饥饿素受体的精确结合模式;PF-05190457的Arm-1位于TM2,TM3间的空隙;Diazaspiro核心通过氢键与受体中D992.60和 S3087.38形成直接相互作用;Arm-2则深入到受体螺旋核心的W6.48-F6.51- F7.42疏水簇附近(图2)。
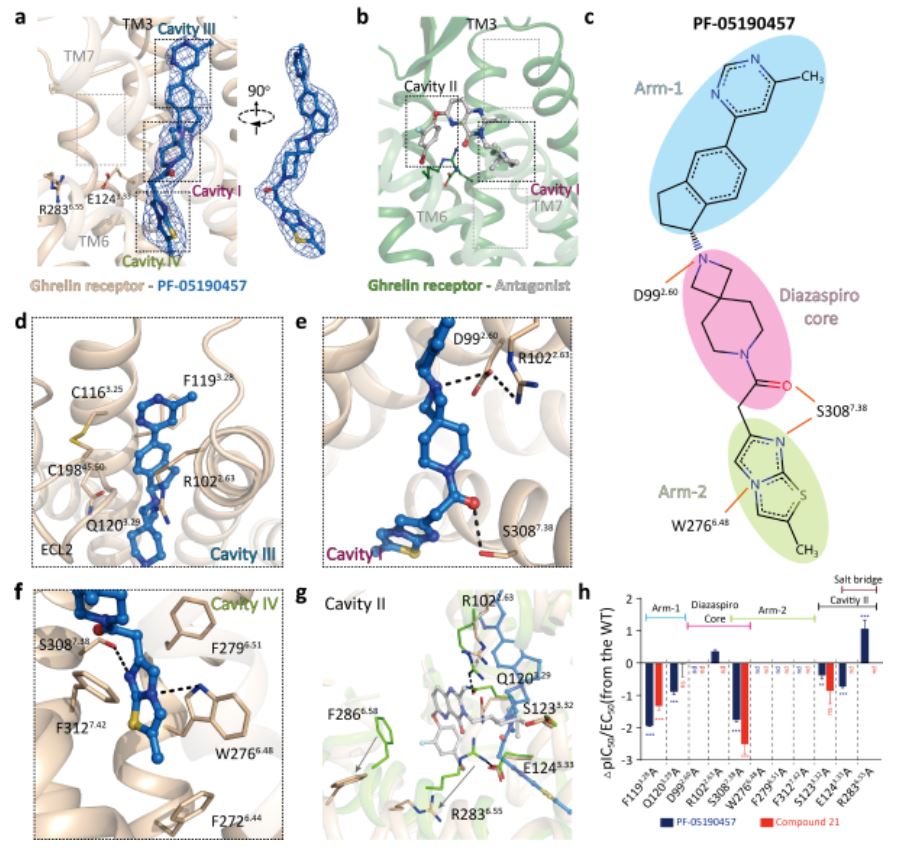
图2 PF-05190457与饥饿素受体的结合方式
研究团队通过比较激动剂饥饿素结合、反向激动剂PF-05190457结合和中性拮抗剂Compound21结合的三种饥饿素受体结构,提出了饥饿素受体激活与反向激动的结合模型。
激动剂饥饿素与受体结合,改变E3.33-R6.55 motif等极性网络和W6.48-F6.51- F7.42疏水簇的方向,通过级联序列重排,引起TM6胞内侧的外移等,最终提高了饥饿素受体与G蛋白的结合能力(图3a)。中性拮抗剂结合于正构位点,维持了 E3.33-R6.55 motif和W6.48-F6.51- F7.4疏水簇的构象(图3b),起到了阻碍饥饿素结合的作用。
而反向激动剂PF-05190457的结合产生了截然不同的构象,通过破坏W6.48-F6.51- F7.42的紧密构象,阻碍E3.33-R6.55 motif中氢键形成,使TM6胞外区大幅移动,并收缩G蛋白结合区,降低受体与G蛋白的结合能力(图3c)。
该研究阐释了饥饿素受体的激活与反向激动的分子机制,为靶向饥饿素受体的药物研发奠定了坚实的结构基础。
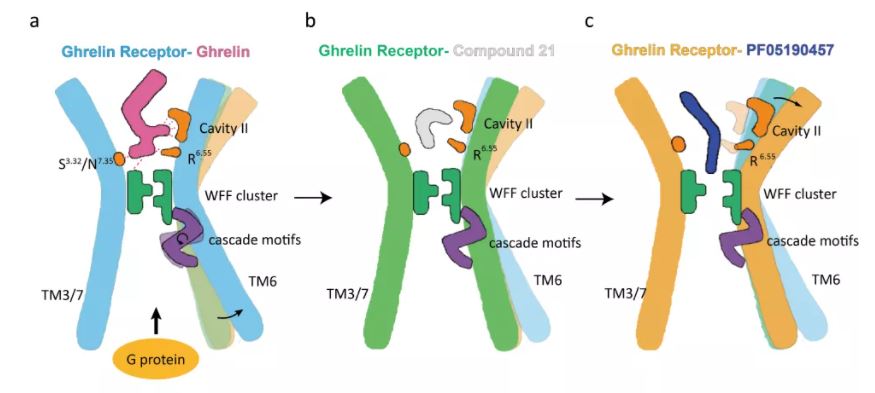
图3 饥饿素受体与激动剂、中性拮抗剂和反向激动剂结合模型
浙江大学基础医学院2020级直博生秦娇、戢素玉,四川大学华西医院2019级硕士研究生蔡叶、博士后徐政、2021级博士研究生吴超,良渚实验室明倩倩博士是该论文的共同第一作者。四川大学华西医院邵振华教授和颜微教授,浙江大学基础医学院/良渚实验室张岩教授,金赛药业新药发现总监马彦彬博士为本文的共同通讯作者。浙江大学冷冻电镜中心和医学院蛋白质平台为本次研究的样品制备和数据收集提供了支持。










