浙江大学基础医学院免疫所王晓健课题组在固有免疫分子调控结肠癌发生发展研究方面取得重要进展,在Nature Communications上发表研究论文“IRF3 prevents colorectal tumorigenesis via inhibiting the nuclear translocation of β-catenin”。该研究发现了固有免疫重要转录因子IRF3通过与β-catenin结合抑制其入核,抑制Wnt信号通路的活化,从而抑制结肠癌的发生与发展。
结直肠癌(CRC)是全世界最常见的恶性肿瘤之一,肠道菌群失调导致的肠组织黏膜的肠道菌群剧烈改变与CRC的发生发展密切相关。然而,肠道菌群在CRC发生和发展过程中的确切机制仍不清楚。肠道菌群通过触发微生物传感器,即Toll样受体(TLR),RIG-I样受体,NOD样受体(NLR),C型凝集素等病原体识别受体(PRR)来诱发先天免疫反应。IRF3是介导PRR信号通路下游信号的关键转录因子,在诱导I型和III型干扰素以及各种IFN刺激基因(ISG)的产生中发挥关键作用。已有研究表明DNA损伤通过激活癌症中的cGAS-STING-IRF3途径促进抗肿瘤免疫。但IRF3是否参与到CRC的肿瘤目前没有报道。
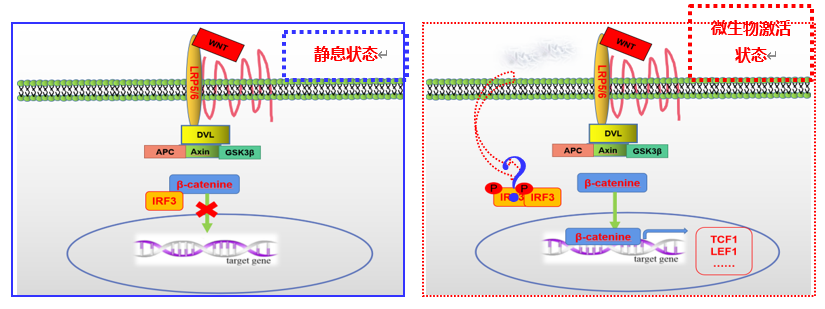
该课题组使用原发性小鼠结肠癌模型,明确肠上皮系统中的IRF3对于结肠癌发生和发展的调控作用及其分子机制,进一步扩展 CRC 的发病调控机制。该研究首次阐明:1.IRF3 缺失显著增加结直肠肿瘤发生过程中的肿瘤数量和肿瘤负荷;2.胞质内非活化的 IRF3直接结合中β-catenin 的ARM 结构域抑制 β-catenin入核,从而抑制 Wnt 信号通路的活化,负相调控结直肠癌的发生;3. 肠道微生物通过活化IRF3, 使其失去抑制Wnt信号通路的功能,促进肠癌的发生; 4.临床数据显示,IRF3 低表达的CRC 、肺腺癌和肝癌患者表现出增强的 Wnt靶基因活化,并且预后较差。以上数据表明 IRF3 可以作为CRC 、肺癌和肝癌治疗的分子靶标。该研究首次发现IRF3 通过 Wnt 信号通路影响肿瘤发生与发展过程,表明IRF3 在肿瘤中发挥重要的作用。并揭示了IRF3的活化参与到肠道微生物调控的肠癌发生。
浙江大学基础医学院博士田苗,硕士王秀美及附属邵逸夫医院放射科孙继红为该论文的共同第一作者。浙江大学基础医学院/附属一院王晓健教授为主要通讯作者,浙江大学附属邵逸夫医院蔡秀军教授为共同通讯作者。该研究受到国家自然科学基金的资助。
原文链接:https://www.nature.com/articles/s41467-020-19627-7#MOESM1










