2020年10月26日,浙江大学基础医学院、浙江大学附属第一医院陈宝惠团队在Nucleic Acids Research杂志在线发表题为“TriTag: an integrative tool to correlate chromatin dynamics and gene expression in living cells”的论文,在单个活细胞内实现了内源特异蛋白编码基因的DNA、新生RNA和蛋白产物的三重实时可视化,因此命名为“TriTag”技术。
“眼见为实”的活细胞成像技术,让细胞世界在生命过程中的各种瞬间能够被直观、连续地进行记录和探索。生物分子标记技术是生物分子成像的关键。把荧光蛋白用于生命科学领域,开启了细胞研究的巨大革命,是基础科学及人类重大疾病研究中最重要的研究工具之一[1]。随着生物分子标记技术的不断发展,荧光蛋白能够分别“点亮”细胞内的DNA、RNA和蛋白质等分子。
为全面了解细胞核的动态调控和功能,美国国立卫生研究院(NIH)在2014年提出了“4D核组计划”(4D Nucleome Project),旨在时间和空间尺度上,结合单细胞测序、单细胞成像等前沿技术,深入理解哺乳动物细胞核的三维结构形成原理及其对基因表达、细胞功能、个体发育和疾病发生发展的影响[2]。因此,细胞核内DNA到RNA到蛋白的信息传递及三者之间的相互协作如何精准实现具有时空特异性的基因表达模式,从而实现特异的细胞及生物个体功能,成为科学家们新的挑战。
TriTag技术通过CRISPR-Cas9介导的DNA重组方法,在特异蛋白编码基因的N端或C端插入一段1.5 kb的TriTag标签,即可集合 DNA、RNA和蛋白三大活细胞成像系统于同一个细胞。这个策略能够直接关联染色质和基因表达(包括转录水平和蛋白产量)的动态变化,直观理解中心法则的信息传递(图1)。该技术可在单个“等位基因”的分辨率下研究基因转录的时空特异性及其动态调控。
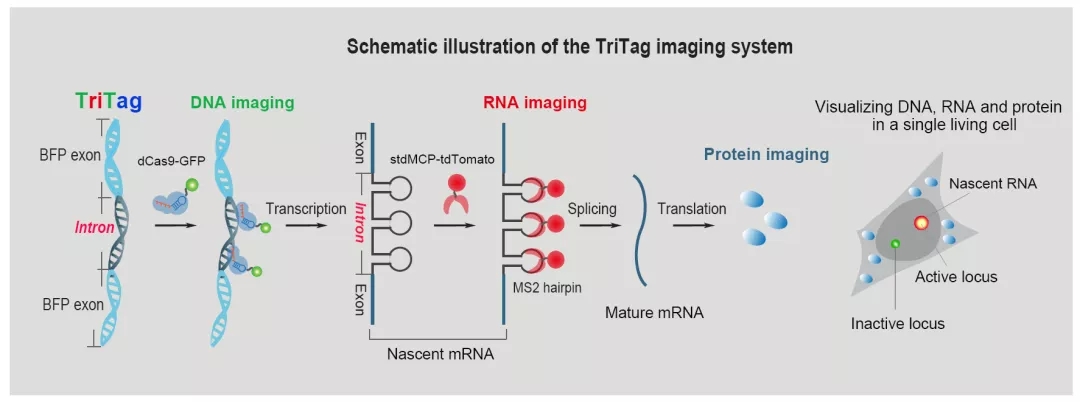
图1. TriTag技术在活细胞内同时可视化DNA、新生mRNA和蛋白的原理示意图
TriTag技术的创新之处是在编码荧光蛋白的DNA序列中添加了一段长约为100个碱基的内含子,并在内含子内加入了可用于DNA成像的CRISPR-Tag元件[2]和可用于RNA成像的MS2基序元件[3]。TriTag成像系统的建立,首先是在细胞内同时表达了dCas9-GFP14X和stdMCP-tdTomato双色荧光报告系统,分别用于DNA和RNA成像。在这个双色稳定细胞系的基础上,可以在感兴趣的蛋白编码基因的N端或C端插入蓝色荧光蛋白版本的TriTag标签,即可实现在活细胞状态下实时记录该基因的染色质状态、转录水平、蛋白产量和蛋白的亚细胞定位(图2)。
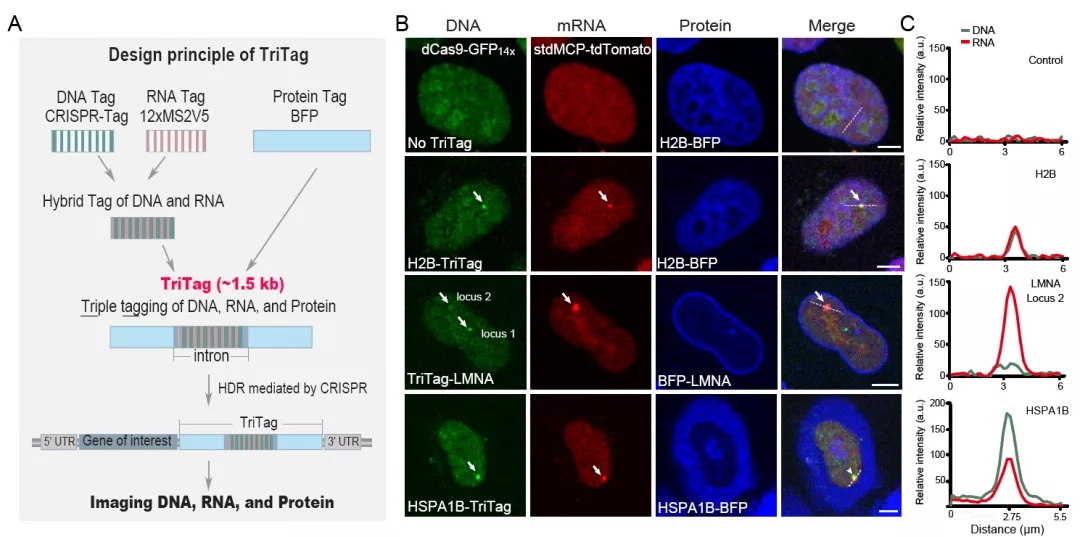
图2 TriTag技术实现人基因的DNA、mRNA和蛋白的三重可视化
TriTag技术将MS2序列放在了荧光蛋白的内含子内,新生RNA一旦在转录中心产生,就能被stdMCP-tdTomato识别并标记。由于mRNA的内含子剪切发生较快,剪切发生后,成熟mRNA不再带有MS2序列而不再被标记。因此转录中心新生RNA的累积量能实时指示转录水平高低。通过活细胞实时成像分析,TriTag系统揭示了管家基因H2B与LMNA的转录是一个间歇性的爆发式过程,简称转录爆发(transcriptional bursting),即转录以“关—开—关”的模式进行转录。H2B与LMNA基因呈现出不同的转录爆发强度(burst amplitude)和爆发频率(burst frequency)(图3)。随着活细胞RNA标记技术的发展,已有不少研究表明了转录爆发的保守性[4]。然而以往的策略大多数把MS2序列插入到靶基因的5’或3’UTR,有可能影响靶基因的蛋白表达。TriTag技术的进步在于把MS2序列放置于荧光蛋白的内含子中,在不影响靶基因的蛋白表达前提下,可实时记录转录爆发模式。同时靶基因位点的DNA标记使得分析更加精确,加上蛋白的表达与定位成像,使得分析更加全面和深入。
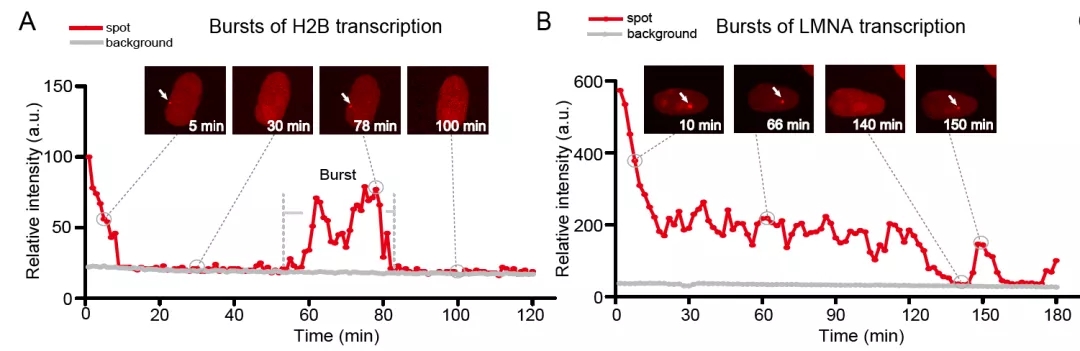
图3 TriTag技术记录基因转录水平的实时波动
TriTag成像可在细胞周期的各个阶段中实现,在单个基因位点的分辨率下,对转录水平与染色质动态进行实时定量分析。该工作运用TriTag技术揭示了以下几点非常有意思的生命现象:1)有丝分裂S期,DNA一旦复制,子链上的基因能够与母链上的基因保持一样的转录状态(图4);2)有丝分裂结束后,母细胞中的基因转录状态能够被两个子细胞继承;3)转录活性高的染色质区域被限制在更小的范围内运动。原因可能是该染色质区域位于转录因子高度聚集的转录中心,该区域形成相分离的液滴[5],促进转录高效进行;4)基因的转录水平大幅升高之前,实时成像显示染色质可能经历了从致密到开放的急剧转变,而这一转变又依赖于转录的发生。TriTag技术将DNA、RNA、蛋白三大成像技术集合成一个在单个细胞内同时实现的成像体系。这样的活细胞成像方式能够捕捉更完整的生命反应。本质上TriTag是一个荧光蛋白标签,但其巧妙的设计赋予了它更多的功能,能更精确地将多个层次的现象直接整合起来分析,有利于推导出更严谨的科学结论。因此,TriTag的运用将在活细胞水平上更好地解析基因表达的时空调控,有望帮助回答印记基因调控、转录记忆(transcriptional memory)及转录-复制冲突(transcription-replication conflicts)等生物学问题。
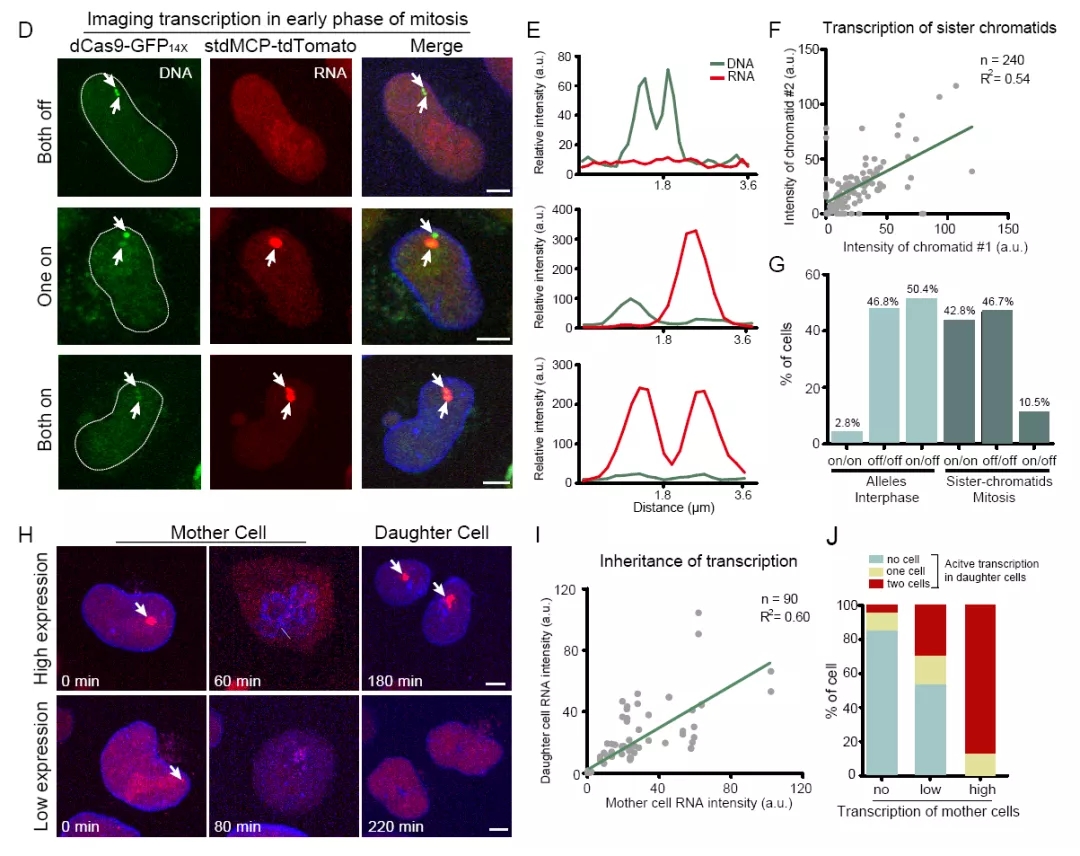
图4 TriTag技术记录细胞分裂中的基因转录动态
浙江大学基础医学院博士研究生徐海月为该研究的第一作者。参与此项工作的作者还包括研究生王君岩、梁鹰、扶玉娟、李思卉、本科生黄靖涵。浙江大学基础医学院陈宝惠研究员为该研究的通讯作者。该研究得到了浙江大学转化医学研究院邹炜研究员和上海交通大学物理与天文学院徐恒研究员的大力支持。
原文链接: https://academic.oup.com/nar/advance-article/doi/10.1093/nar/gkaa906/5940501
参考文献
1. Specht, E.A., E. Braselmann, and A.E. Palmer, A Critical and Comparative Review of Fluorescent Tools for Live-Cell Imaging. Annu Rev Physiol, 2017. 79: p. 93-117.
2. Dekker, J., et al., The 4D nucleome project. Nature, 2017. 549(7671): p. 219-226.
3. Chen, B., et al., Efficient labeling and imaging of protein-coding genes in living cells using CRISPR-Tag. Nat Commun, 2018. 9(1): p. 5065.
4. Bertrand, E., et al., Localization of ASH1 mRNA particles in living yeast. Mol Cell, 1998.2(4):p. 437-45.
5. Suter, D.M., et al., Mammalian genes are transcribed with widely different bursting kinetics. Science, 2011. 332(6028): p. 472-4.
6. Plys A.J., Kingston R.E. Dynamic condensates activate transcription. Science, 2018. 361(6400): p. 329-330.










