如果要将正在教室里上课的100名学生分成两个小班,你会怎样分配?是随机分配,还是按照一定的类别,比如男生、女生来归类?显然随机分配更简单,归类分配操作难度更大。
其实,类似这样的一幕每时每刻都在我们的生命体中上演,这就是细胞分裂,即活细胞增殖并且由一个细胞分裂为两个细胞的过程。细胞分裂通常包括细胞核分裂和细胞质分裂两部分,其中在核分裂的过程中母细胞就把遗传物质传递给了子细胞,维持了生命遗传信息的延续。
那细胞分裂时胞内物质是无规律地随机分配给两个子代细胞还是按一定法则非随机分配的呢?过去的传统观念认为,母细胞在细胞分裂时细胞成分是均等分布到一对子细胞中的。但是,约半世纪前科学家发现,细胞分裂时染色体存在非随机分配的可能性,不过背后的相关机制和可能的驱动因素一直没有得到充分的研究和阐释。
近日,浙江大学基础医学院兼医学院附属第二医院呼吸与危重症医学科应颂敏教授、浙江大学医学院附属第二医院呼吸与危重症医学科沈华浩教授课题组在实验中观察到了有丝分裂中染色体的非随机分配现象即一个子细胞里的染色体DNA完好无损,而另一个子细胞里的染色体DNA却伤痕累累,伴有明显的DNA损伤修复反应。研究人员发现ATR/CHK1信号通路在对损伤染色体的非随机分配过程中起着至关重要的调控作用,看似“生命体非常聪明地通过这种方式来‘保种’”。
北京时间4月30日凌晨,国际著名的Cell子刊《分子细胞》(Molecular cell)在线刊登了这项工作。浙江大学基础医学院兼医学院附属第二医院呼吸与危重症医学科应颂敏教授、浙江大学医学院附属第二医院呼吸与危重症医学科沈华浩教授和丹麦哥本哈根大学Ian D. Hickson教授为论文的共同通讯作者。基础医学院2015级博士研究生邢美春和2016级博士研究生张凤娇为论文的共同第一作者,应颂敏教授、沈华浩教授和丹麦哥本哈根大学Ian D. Hickson教授为论文的共同通讯作者。

一场细胞有丝分裂中的染色体木偶戏
在约半世纪前的一项研究中,科学家发现,细胞非随机分配时,母细胞会分裂成两个不同的子细胞,即一个是“新”细胞,一个是“旧”细胞。2013年,应颂敏回国在浙江大学任教,在一次带领本科学生做创新实验时,意外观察到了一对外表长得很像但内在并不相同的“双胞胎”细胞,也就是非常少见的细胞分裂的不对称分配现象。
通过免疫荧光染色的方法,他们发现,这对以往被称为“新”细胞和“旧”细胞的双胞胎藏着一个大奥秘。“旧”细胞继承的母细胞的染色体DNA都是完好的,而“新”细胞中的染色体DNA却有很多是受损的,“表面上看是新旧的区分,实质上是损伤与非损伤染色体的分配。”应颂敏说。
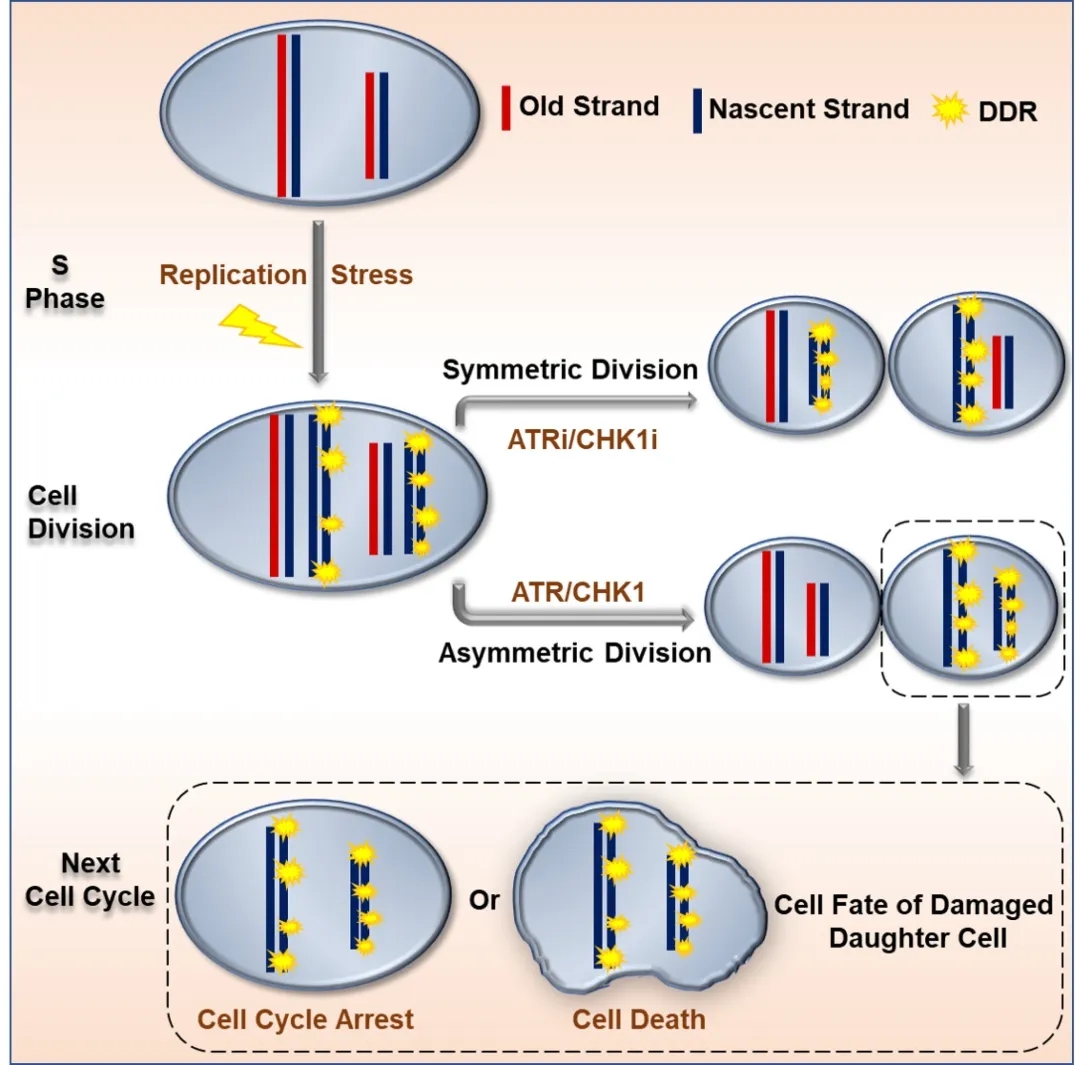
依赖于ATR/CHK1信号通路的损伤染色体非随机分配最终导致了子代细胞的不同命运
原来,细胞增殖、分裂的过程中,充满着各种挑战,有可能出现染色体DNA损伤的情况,这时候生命体会尽快地开展自我修复,但有的时候,受损的染色体DNA并不能在细胞分裂之前被完全修复。在这样的情况下,如果细胞分裂还是随机分配,就会把受损的染色体DNA同时遗传给两个子细胞,然后2传4,4传8,最终造成不可估量的后果。
这个时候,“隔离”也是一种爱。母细胞非常聪明地在分裂过程中进行了调配,无损伤的染色体都去了其中一个子代细胞,并使其保留了增殖能力,而损伤的染色体都被“隔离”到了另一个同胞子代细胞中,并倾向于发生细胞周期阻滞或细胞死亡。
“正是因为这样的隔离,好的子代细胞可以进一步发育和增殖,不好的子代就被淘汰掉了。”应颂敏说,隔离受损细胞这一调配作用可能在干细胞发育时也起到保证生命种子长期存活的关键作用,“这涉及到非常基础的生命学现象,关系到细胞在进化过程中如何将完好的遗传信息保留到一个子代细胞中。”
我们知道,人体内有23对染色体,每一对染色体的分配概率都是二分之一。如果没有一种高效的调控机制,所有的23对染色体均发生非随机分配的概率就是2的23次方分之一,这个机率是非常小的。这也是不对称分配现象难以被我们观察到、研究透的原因之一。
课题组成员说,在100个细胞中,大约有个位数的细胞处于分裂进行式,而正在分裂的大部分又是随机分配的,这样估算下来,大概要观察成千上万个细胞才能看到一个处于非随机分配中的细胞。“这是非常大的工作量。同学们在暗房里用共聚焦显微镜观察,常常一呆就是一整天。”
而要发生非随机分配还有一个前提条件,就是染色体出现损伤而且在细胞分裂之前没有被修复。那么染色体损伤一般在什么情况下会出现呢?课题组成员说,在DNA复制过程中,会出现各种情况,就像俄罗斯方块那样不是所有地方都是严丝合缝的,可能这里出现一个错位,那里又有一格是空着的。还有,DNA末端的端粒部分特别不容易复制,一旦复制不好就会出现损伤。这种复制障碍被称为复制压力。一些细小的损伤在非随机分配后聚沙成塔,导致受累细胞DNA伤痕遍布,“就像两只双胞胎的猫,一只是白猫,一只是黑猫,具有很明显的差异。”

应颂敏教授与课题组成员
内部因素如肿瘤原癌基因的激活、外部因素如影响DNA复制的化学药物等也都会造成DNA损伤。当这些损伤没有被完美修复的时候就可能会触发不对称分配。
在正常细胞中,非随机分配相当于是筑起了生命繁衍的一道最后防线,保证把完好的染色体信息一代代传递下去。而在肿瘤细胞中,非随机分配则可能起到了利好肿瘤生长的作用。如果能够掌握非随机分配的发生机制,就能让我们更深刻地理解肿瘤快速增殖和耐药的原因,为肿瘤精准治疗提供潜在的靶向方案。
那么这种非随机分配是如何产生的呢?研究人员认为,从原理上看,首先是细胞要识别出染色体复制有无问题,如果发现有问题,再下达非随机分配的信号并开展分离,最后将有损伤的染色体尽可能地完全隔离开。但这“三步曲”究竟是怎样发生的,课题组还没有解开最终的谜团。
不过,课题组有另外一个重要的发现。他们在实验中对多条信号通路进行了筛查,结果发现,通过调控ATR/CHK1这条通路,可以在一定程度上控制非随机分配的发生。
“ATR/CHK1通路肯定在这三步曲中起了作用,但是究竟如何起作用还不清楚。”课题组成员说,此前ATR/CHK1已经在临床上作为肿瘤靶向治疗的靶点,多个化合物均在临床试验。本项研究为明晰肿瘤发生机制和精准靶向治疗提供了新的理论依据。
应颂敏认为,这项研究成果最重要的是给大家提供了一种新的研究视角。“自然界的生命体是非常智慧的。细胞一旦出现损伤,都会先进行修复,实在修复不好,还会有最后一道防线,就是通过非随机分离来隔离受损部分,以保证整个群体的利益最大化。”这也正是课题组七年以来一直孜孜探索的原因。
正如文章的匿名评审专家所说,这项工作开辟了一个新的领域,之后各个相关领域的科学家可以从不同视角来跟进验证并进一步开展深入研究。
原文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(20)30231-8










