促肾上腺皮质激素释放因子受体(Corticotropin-Releasing Factor Receptors) CRF1R和CRF2R是B类GPCR的重要成员,在中枢和外周神经系统中广泛表达,主要通过偶联下游Gs蛋白参与体内内分泌系统、行为系统和免疫系统的压力应答(1)。研究表明,CRF1R可能与压力导致的酗酒和药物滥用相关(2)。CRF1R和CRF2R在体内被内源性配体CRF和UCN1-3 (urocotins 1-3)激活。CRF初次在羊下丘脑中被发现,能促进促肾上腺皮质激素(Adrenocorticotropic hormone, ACTH)的释放从而在下丘脑-垂体-肾上腺轴(Hypothalamic–pituitary–adrenal, HPA)中发挥关键作用(3,4)。与UCN1对CRF1R和CRF2R都有高亲和力不同,CRF对CRF1R的亲和力明显高于CRF2R,而UCN2和UCN3则表现出了CRF2R选择性激动剂的特性(5-7)。
2020年1月30日, 浙江大学基础医学院张岩课题组与中国科学院上海药物研究所徐华强课题组合作在Molecular Cell发表了题为Molecular Basis for Hormone Recognition and Activation of Corticotropin-Releasing Factor Receptors的研究论文。研究人员利用Bac-to-Bac杆状病毒表达系统在sf9昆虫细胞中共表达CRF1R/CRF2R、Gαs、Gβ1、Gγ2四个亚基,依托浙江大学冷冻电镜中心(http://ccem.zju.edu.cn)解析了CRF1R和CRF2R两个亚型在内源性配体UCN1激活下与Gs蛋白三聚体复合物的三维结构,分辨率分别为3.0 Å和2.8 Å,为针对压力应答、焦虑、抑郁和心脑血管疾病的药物研发提供了强有力的结构基础。
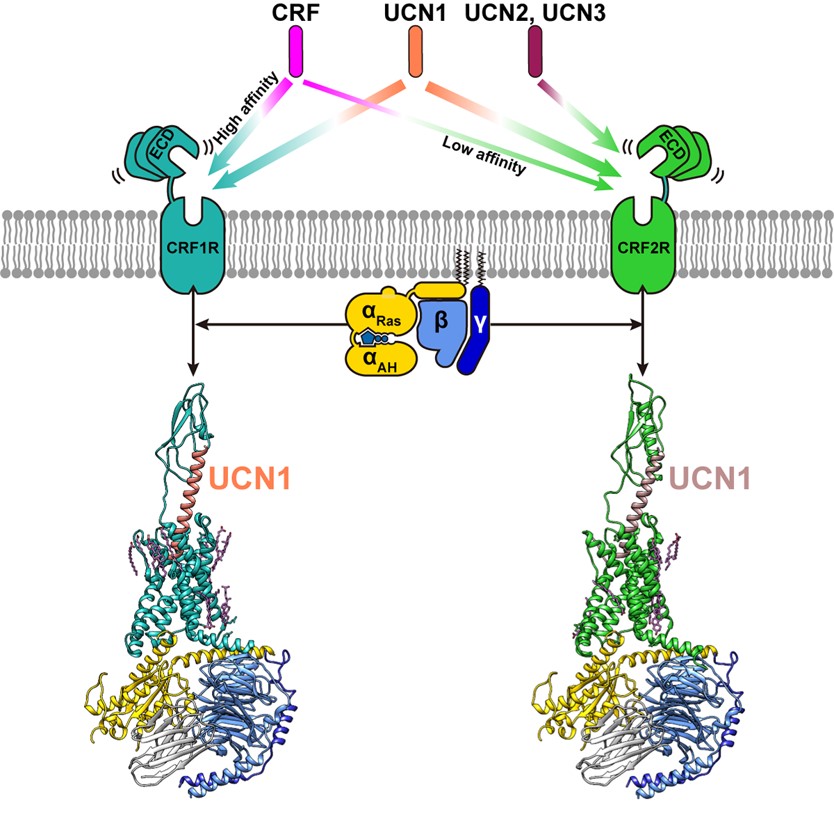
图1:促肾上腺皮质激素释放因子受体与配体的结合特异性和与Gs蛋白复合物的冷冻电镜结构。
该三维结构清晰地揭示了CRF受体特异性识别并结合UCN1的分子机制和招募下游效应蛋白Gs蛋白发挥生理功能的结构基础。相比于其他B类GPCR的多肽配体,UCN1具有独特的结构特征:UCN1的N端7个氨基酸后折形成环状,随后的33个氨基酸以一个长α螺旋的形式垂直插入受体跨膜区,其中配体的C端结合受体的胞外区,配体的N端结合受体的跨膜区。
同期,张岩研究员还参与了另外一项研究,以背靠背的形式发表,解析了CRF-CRF1R-Gs复合物的冷冻电镜结构(Towards a structural understanding of class B GPCR peptide binding and activation)。将两篇文章中报道的三个CRF受体激活态结构进行对比后发现,CRF多肽和CRF2R的表面有较多的负电荷,而CRF1R的表面正电荷居多,这也从结构方面解释了为什么CRF对CRF1R具有更高的亲和力。
B类GPCR正确发挥生理功能需要精确的配体识别,但这一调控过程的具体机制仍不清楚。该工作成果结合之前报道的多个B类GPCR激活态结构为系统分析归纳总结该家族受体与配体相互作用机制提供了良好契机。目前已经获得结构解析的B类GPCR有:胰高血糖素样肽1受体GLP1R(8,9)、降钙素受体CTR(10)和人源甲状旁腺激素受体1型PTH1R(11)。其中前两者是世界上首次报道的GPCR信号转导复合物冷冻电镜结构;后者也同样是由徐华强课题组和张岩课题组联合其他实验室攻关完成。对以上结构进行比较发现,结合配体C端的胞外区呈现出了最大的构象差异,结合配体N端的跨膜区尽管宏观上没有显著区别,但配体结合口袋的形状大小和组成该口袋的氨基酸因受体而异。依据配体小肽在结合口袋的结构可将B类GPCR家族的多肽配体分为CRF样肽、降钙素样肽、胰高血糖素样肽三类。因此B类GPCR精确的配体识别主要分两步进行,第一步是受体胞外区快速识别配体C端,随后配体N端深入结合受体跨膜区,这也是决定配体特异性的关键一步。这种两步识别的模式阻止了B类GPCR错误识别配体的发生。
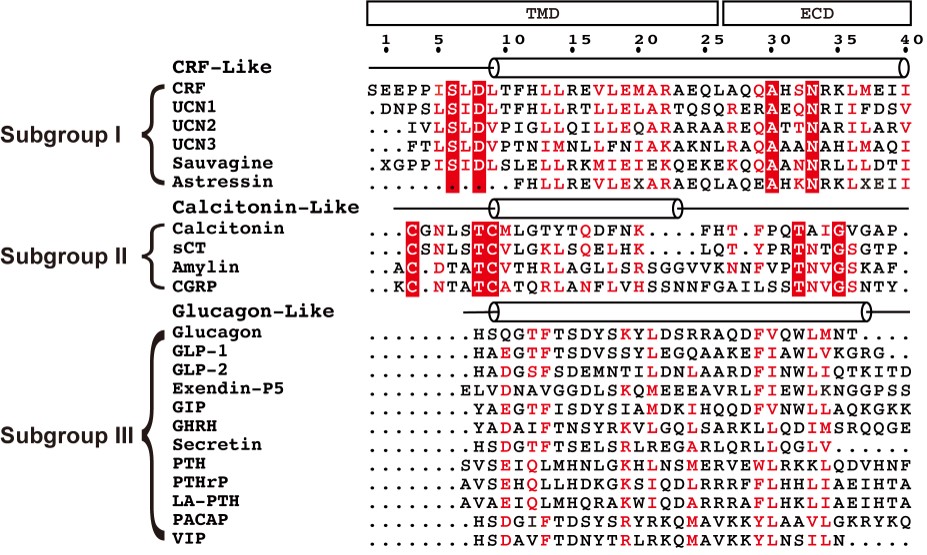
图2:B类GPCR家族多肽配体分类
通过与已解析的失活态的CRF1R跨膜区结构(PDB:4K5Y)比较发现(12),CRF1R被激活后构象变化主要集中在TM5、TM6、TM7,其中TM6在P3216.47b -G3246.50b处解螺旋并形成一个90°的扭曲,该变化被N2835.50b和Q3557.49b之间的氢键所稳定,从而为招募Gs蛋白提供足够的空间。受体的跨膜螺旋与Gαs的α5螺旋的相互作用和受体的Helix 8螺旋与Gβ1的N端的相互作用是受体与Gs蛋白的主要作用界面。这种在B类GPCR中高度保守的“NPGQ”氨基酸和与Gs的作用界面,进一步揭示了B类GPCR被激活的普遍机制。
和研究团队此前解析的长效激活状态的PTH1R信号转导复合物类似(11),在UCN1-CRF1R/CRF2R-Gs复合物受体跨膜区周围,研究人员也发现了许多有序排列的脂质和胆固醇分子,在Gαs和Gβγ亚基中发现了脂修饰部分。为研究这些脂质分子对膜蛋白的作用,研究人员选择了两个与电子密度高度吻合且在三个结构中相对保守的胆固醇分子,发现作用于这两个胆固醇分子的氨基酸不仅在B类GPCR中高度保守,而且被突变后CRF1R和CRF2R与配体CRF和UCN1的亲和力大大降低,这证明脂质在稳定膜蛋白和与配体的识别中发挥重要作用。
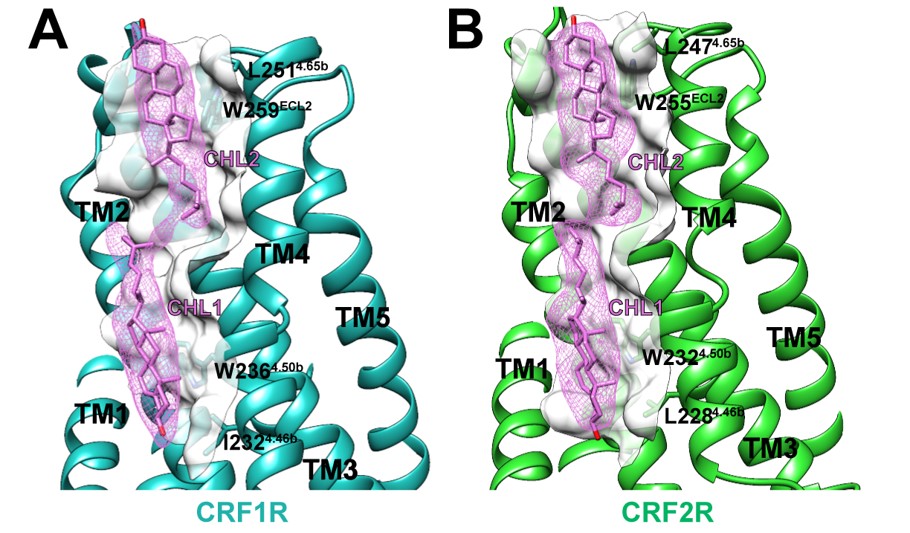
图3:CRF1R与CRF2R复合物结构中的胆固醇分子
该研究解析的全激活状态的促肾上腺皮质激素释放因子受体CRF1R、CRF2R与Gs蛋白三聚体的结构揭示了配体识别的特异性,阐明了B类GPCR激活的普遍机制,并进一步为研究膜蛋白和脂质之间的相互作用和靶向CRF1R、CRF2R的合理药物设计提供了详细的结构信息。
据悉,浙江大学医学院张岩课题组博士后沈庆亚与上海药物研究所马山山以及赵丽华为该论文的共同第一作者。徐华强、张岩和赵丽华为共同通讯作者。两个研究团队紧密协作,长期致力于B类GPCR的结构和功能研究。
该项工作获得浙江省杰出青年基金的资助。
1 MILLAN, M. A., SAMRA, A.-B. A., WYNN, P. C., CATT, K. J. & AGUILERA, G. Receptors and Actions of Corticotropin-Releasing Hormone in the Primate Pituitary Gland. The Journal of Clinical Endocrinology & Metabolism 64, 1036-1041, doi:10.1210/jcem-64-5-1036 (1987).
2 Nie, Z. et al. Ethanol Augments GABAergic Transmission in the Central Amygdala via CRF1 Receptors. Science (New York, N.Y.) 303, 1512-1514, doi:10.1126/science.1092550 (2004).
3 Morimoto, A., Nakamori, T., Morimoto, K., Tan, N. & Murakami, N. The central role of corticotrophin-releasing factor (CRF-41) in psychological stress in rats. The Journal of physiology 460, 221-229 (1993).
4 Vale, W., Spiess, J., Rivier, C. & Rivier, J. Characterization of a 41-residue ovine hypothalamic peptide that stimulates secretion of corticotropin and beta-endorphin. Science (New York, N.Y.) 213, 1394-1397 (1981).
5 Reyes, T. M. et al. Urocortin II: A member of the corticotropin-releasing factor (CRF) neuropeptide family that is selectively bound by type 2 CRF receptors. Proceedings of the National Academy of Sciences 98, 2843-2848, doi:10.1073/pnas.051626398 (2001).
6 Lewis, K. et al. Identification of urocortin III, an additional member of the corticotropin-releasing factor (CRF) family with high affinity for the CRF2 receptor. Proceedings of the National Academy of Sciences of the United States of America 98, 7570-7575, doi:10.1073/pnas.121165198 (2001).
7 Donaldson, C. J. et al. Cloning and characterization of human urocortin. Endocrinology 137, 2167-2170, doi:10.1210/endo.137.5.8612563 (1996).
8 Liang, Y.-L. et al. Phase-plate cryo-EM structure of a biased agonist-bound human GLP-1 receptor–Gs complex. Nature 555, 121, doi:10.1038/nature25773
https://www.nature.com/articles/nature25773#supplementary-information (2018).
9 Zhang, Y. et al. Cryo-EM structure of the activated GLP-1 receptor in complex with a G protein. Nature 546, 248-253, doi:10.1038/nature22394 (2017).
10 Liang, Y. L. et al. Phase-plate cryo-EM structure of a class B GPCR-G-protein complex. Nature 546, 118-123, doi:10.1038/nature22327 (2017).
11 Zhao, L.-H. et al. Structure and dynamics of the active human parathyroid hormone receptor-1. Science (New York, N.Y.) 364, 148-153, doi:10.1126/science.aav7942 (2019).
12 Hollenstein, K. et al. Structure of class B GPCR corticotropin-releasing factor receptor 1. Nature 499, 438, doi:10.1038/nature12357
https://www.nature.com/articles/nature12357#supplementary-information (2013).
原文链接:
https://doi.org/10.1016/j.molcel.2020.01.013
https://doi.org/10.1016/j.molcel.2020.01.013