巨噬细胞的代谢和线粒体适应性
免疫细胞功能在很大程度上受其代谢活动的影响,因此免疫细胞需要获取特定的代谢适应性以支持其多样的免疫学功能。巨噬细胞作为固有免疫的重要成员,其功能发挥受到代谢途径和代谢产物的严格调控。例如炎症性巨噬细胞(inflammatory macrophage)具有增强的糖酵解代谢(glycolytic metabolism)以及抑制的线粒体氧化磷酸化(OXPHOS)。线粒体作为细胞代谢中心对免疫细胞功能的调控作用也逐渐被揭示。例如伴随电子传递链(electron transport chain, ETC)过程产生的线粒体活性氧(mtROS),根据其产生的量和时机,可以触发先天免疫信号或引发细胞损伤;与此同时,线粒体形态的变化(mitochondrial dynamics)及其对免疫细胞功能的调控也获得了广泛关注。
HDAC3
组蛋白去乙酰化酶3(histone deacetylase 3, HDAC3)被广泛认为是细胞核中的表观调节因子,与协同阻遏物SMRT(silencing mediator of retinoic acid and thyroid hormone receptor)和NCoR 1(nuclear receptor co-repressor 1)协同促进组蛋白脱乙酰基化,调节发育和生理过程所需的大量基因转录。然而,其对炎症的贡献在很大程度上仍是未知的,特别是依赖caspase-1介导的IL-1β和IL-18成熟加工的炎症阶段。
2020年9月15日,浙江大学基础医学院王迪教授课题组池哲勖(博士后)和陈晟(八年制第5年)作为共同第一作者在Molecular Cell杂志发表研究论文“Histone Deacetylase 3 Couples Mitochondria to Drive IL-1β-Dependent Inflammation by Configuring Fatty Acid Oxidation”,揭示了组蛋白脱乙酰基酶3(HDAC3)通过非组蛋白脱乙酰基功能(non-histone deacetylation)塑造巨噬细胞在IL-1β成熟加工过程中的脂肪酸氧化和线粒体代谢适应性。与其经典功能不同的是,在炎症小体介导的炎症过程中,HDAC3转位至线粒体并去乙酰化线粒体脂肪酸氧化关键酶HADHA(mitochondrial trifunctional enzyme subunit α)并使其活性下降,帮助巨噬细胞获得脂肪酸氧化和线粒体形态上的适应性,并最终促进了IL-1β的产生。
体内炎症反应的改变
研究人员通过构建HDAC3髓系条件性敲除小鼠(LysM-Cre-HDAC3),发现这些小鼠在脓毒症模型中血清炎症因子水平,腹腔及脾脏巨噬细胞caspase-1活化等指标上均显著下降并有更好的生存率。在肥胖诱发的2型糖尿病模型中,HDAC3条件性敲除小鼠具有明显缓解的慢性炎症和糖尿病症状,同时在附睾脂肪中浸润的炎症性巨噬细胞(CD206loCD11chi)比例也显著降低。
代谢调节与分子机制
研究人员利用Seahorse检测发现HDAC3缺失的巨噬细胞有着更强的线粒体氧化磷酸化(OXPHOS)和脂肪酸氧化(FAO)水平。同位素标记代谢流以及BODIPY染色也证明HDAC3敲除的巨噬细胞会更多地利用外源脂肪酸以支持线粒体的FAO。伴随这种升高的FAO,HDAC3缺失的巨噬细胞线粒体也表现出更高的线粒体膜电位,更少的断裂形态(fragmented),以及mtROS的产生。这也表明HDAC3对于巨噬细胞在IL-1β成熟加工过程中获取线粒体的适应性(mitochondrial adaptations)至关重要。
研究人员进一步利用生化、PLA (Proximal ligation assay)、免疫胶体金等一系列手段证实HDAC3在炎症小体活化过程中靠近线粒体,并利用TMT-labeled乙酰化蛋白质组发现HDAC3首要去乙酰化FAO关键限速酶HADHA。通过domain mapping,最终确定HDAC3去乙酰化HADHA的K303位点,并证明这一位点的乙酰化修饰可以通过影响HADHA与底物的结合从而抑制其酶活性。HADHA的特异性抑制剂曲美他嗪(Trimetazidine)以及HADHA-K303R突变体(模拟乙酰化)则可以显著增加巨噬细胞IL-1β的产生。
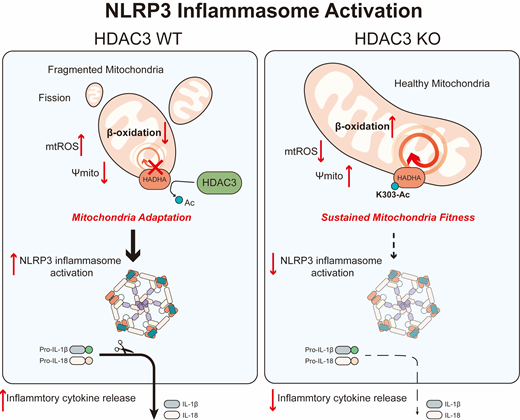
本研究的意义体现在揭示了HDAC3的非经典功能并调控炎症的发生,发现在巨噬细胞炎症小体活化过程中,HDAC3的线粒体转位并去乙酰化FAO关键酶HADHA从而帮助巨噬细胞获得线粒体代谢和形态的适应性,并表明HDAC3可能作为炎症过程中重要的脂代谢控制节点。该工作得到了基础医学院生物物理系杨帆研究员的帮助和支持。

原文链接:https://www.cell.com/molecular-cell/fulltext/S1097-2765(20)30578-5#%20